Метаболический синдром и тромбофилия – состояние высокого риска у беременных
Для цитирования: Пшеничникова Е.Б., Пшеничникова Т.Б., Макацария А.Д. Метаболический синдром и тромбофилия – состояние высокого риска у беременных. РМЖ. 2006;53-60.
Статья посвящена проблеме метаболического синдрома и тромбофилии у беременных
- Синдром «благополучного состояния» [Mehnert H., 1964];
- Полиметаболический синдром [Grepaldi G., 1965];
- Синдром Х [Reaven G., 1989];
- «Смертельный квартет» [Kaplan N., 1989];
- Гормонально-метаболический синдром [Bjorntorp, 1991];
- Синдром инсулинорезистентности [DeFronzo R., 1991];
- Генерализованная сердечно-сосудистая метаболическая болезнь [L.M. Resnick, 1993];
- «Смертельный секстет» [Enzi G., 1994];
- Метаболический сосудистый синдром [Hanefeld M., 1997];
- Метаболическая петля [Волкова Э.Г., 1998].
- висцеральное (абдоминальное) ожирение
- инсулинорезистентность
- гиперинсулинемия
- нарушение толерантности к глюкозе (НТГ) или СД 2 типа
- артериальная гипертензия
- дислипидемия
- нарушения гемостаза
- гиперурикемия
- микроальбуминурия.

В 90-е годы в связи с прогрессом в понимании молекулярных механизмов тромбофилии стала выясняться роль различных форм тромбофилии не только в структуре тромбозов и тромботических осложнений, но и в структуре репродуктивных потерь, обусловленных невынашиванием беременности, гестозами, преждевременной отслойки нормально расположенной плаценты (ПОНРП). Абсолютное большинство генетических и приобретенных форм тромбофилии клинически манифестируют именно в течение гестационного процесса, как оказалось, не только в форме тромбозов, но и в форме типичных акушерских осложнений. Целый ряд осложнений беременности – синдром потери плода, гестоз, ПОНРП, синдром задержки развития плода – могут быть связаны с генетическими и комбинированными формами тромбофилии. Патогенез большинства осложнений связан с нарушением процессов имплантации, инвазии трофобласта в децидуальную оболочку, плацентации. Процесс имплантации, инвазии трофобласта и дальнейшее функционирование плаценты представляются многоступенчатым процессом эндотелиально-гемостазиологических взаимодействий, который нарушается при тромботической тенденции и в случае генетических дефектов свертывания. С точки зрения влияния тромбофилии наиболее ярким примером являются полиморфизм PAI-1 и другие генетически обусловленные дефекты фибринолиза с повышением уровня PAI-1 и гиперфибриногенемией и АФА. Тромбофилия, в том числе и генетически обусловленная, усиливает протромботические механизмы. И в условиях гипофибринолиза (как в результате полиморфизма PAI-1, так и других причин) происходит десинхронизация процессов фибринолиза и фибринообразования, что может вести к дефектам имплантацции и снижению глубины децидуальной инвазии трофобласта. Если при этом имеет место и циркуляция антифосфолипидных антител, то это усугубляет ситуацию. Неполноценные инвазия трофобласта и ремоделирование спиральных артерий ведут к нарушению плацентарной перфузии. При этом недостаточная инвазия трофобласта в дальнейшем определяет «эндотелиальный» феномен гестоза, что подразумевает эндотелиальный генез развивающихся при этом нарушений.
В акушерской практике ожирение и генетически обусловленная тромбофилия входят в ряд основных факторов риска развития тромбоэмболических осложнений [6].
Принимая во внимание тот факт, что метаболический синдром часто сочетается с тромбофилическими осложнениями, а также роль тромбофилии в акушерской патологии, следует сказать, что женщины с метаболическим синдромом входят в группу высокого риска по развитию разнообразной акушерской патологии.
Таким образом, разработка основных принципов ведения беременности и безопасного родоразрешения у женщин с метаболическим синдромом является актуальной проблемой современных исследований в этой области.
Исследование, проводившееся нами в 2003-2005 годах на клинической базе кафедры акушерства и гинекологии МПФ ММА имени И.М. Сеченова – в специализированном родильном доме для беременных с заболеваниями сердечно-сосудистой системы при городской клинической больнице № 67 г. Москвы, у 77 пациенток с метаболическим синдромом в возрасте от 25 до 42 лет, показало следующую особенность акушерско-гинекологического анамнеза.
В анамнезе в 100% случаев имела место акушерская патология в предшествующие беременности:
— синдром потери плода (СПП) – преэмбрионические потери, ранние выкидыши в анамнезе (1 и более выкидыш, неразвивающаяся беременность до 12 недель), поздние выкидыши в анамнезе (антенатальная гибель плода, 1 и более выкидыш после 12 недель, неонатальная смерть, как осложнение преждевременных родов, тяжелого гестоза или фето-плацентарной недостаточности) в 84,4% случаев;
— фето-плацентарная недостаточность (ФПН) в предшествующие беременности в 71,4% случаев;
— среднетяжелая и тяжелая степень гестоза в предшествующие беременности в 75,3% случаев.
Все обследуемые женщины имели отягощенный наследственный анамнез. Отягощенный семейный анамнез по ожирению был у 52 (67,5%) женщин; по сердечно-сосудистым заболеваниям (ИБС, инфаркт миокарда, АГ, инсульт) – у 62 (80,5%) обследуемых; по ИНСД – у 25 (32,5%), по злокачественным новообразованиям различной локализации – у 11 (14,3%), по варикозному расширению вен нижних конечностей – у 53 (68,8%) обследуемых.
Все женщины были разделены на две группы: I группа (n=32) – женщины получали терапию, начиная c фертильного цикла, II группа (n=45) – беременные женщины, обследованные и получавшие терапию со II или III триместра беременности.
Контрольная группа 30 человек – соматически здоровые женщины с физиологическим течением беременности.
Диагноз метаболический синдром был поставлен согласно рекомендациям Национального института здоровья США.
В процессе ведения женщин с метаболическим синдромом использовали следующий алгоритм обследования. При первом обращении женщины подробно выяснялся ее соматический и акушерско-гинекологический анамнез. Далее проводилось полное клинико-лабораторное обследование: объективное обследование (измерение уровня АД), антропометрические измерения (индекс массы тела, окружность талии, окружность бедер).
Инструментальные методы исследования включали УЗИ, допплерометрическое исследование, кардиотокографию в динамике, ЭКГ, ЭхоКГ.
Мы также полагаем необходимым проведение гормональных исследований, включающих определение в крови лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), пролактина (ПРЛ), эстрадиола (Э2), прогестерона (П), тестостерона (Т), ДГЭА-С, кортизола на 5-7-й день самостоятельного или индуцированного менструального цикла и Э2, прогестерона, тестостерона на 21-23-й день цикла, а также соотношение Р/Э2, Т/Э2.
Лабораторные исследования включали клинический анализ крови, биохимический анализ крови (глюкоза, ТГ, холестерин), общий анализ мочи, а также исследование системы гемостаза (АЧТВ, ПИ, степень агрегации тромбоцитов с различными агонистами, РКМФ, Д-димер, определение ВА, парус-тест, тромбоэластограмма, комплексы ТАТ, F1+2); выявление генетических форм тромбофилий методом ПЦР (мутации MTHFR C677T, протромбина G20210A, полиморфизм гена «675 4G/5G» PAI-1, полиморфизм «807C/T» в гене гликопротеина Gp-Ia тромбоцитов, полиморфизм «I/D» в гене тканевого активатора плазминогена, полиморфизм «I/D» в гене АПФ, полиморфизм «455G/A» в гене фибриногена, полиморфизм «1565 T/C» в гене гликопротеина Gp-IIIa тромбоцитов, полиморфизм « 1166 А/С» в гене рецептора ангиотензина II 1 типа, мутация FVLeiden; антифосфолипидные антитела –АФА).
Определение циркуляции молекулярных маркеров тромбинемии и фибринообразования (ТАТ, F1+2, Д-димер, PF4) позволяло не только диагностировать реально существующую тромбофилию, но также контролировать эффективность противотромботической профилактики. В нашем исследовании в 100% случаев наблюдалось повышение уровня маркеров тромбофилии и агрегационной активности тромбоцитов.
При диагностировании наследственной, мультигенной формы тромбофилии или комбинированной тромбофилии назначали терапию в зависимости от причины и степени ее выраженности, наличия гомо- или гетерозиготной формы мутации, маркеров тромбофилии.
В качестве антитромботической терапии применяли низкомолекулярный гепарин – НМГ. Доза препарата корректировалась в зависимости от уровней маркеров тромбофилии, агрегационной активности тромбоцитов, веса беременной женщины. В случае положительных тестов на молекулярные маркеры тромбинемии и фибринообразования (ТАТ, F1+2, Д-димер, PF4), отражающих реальную тромбофилию, антитромботическая терапия назначалась немедленно. НМГ применяли на протяжении всей беременности, отменяя за сутки до родоразрешения. Через 8 часов после родоразрешения его прием возобновлялся и продолжался в течение 10 дней. Контролем эффективности противотромботической терапии являлись маркеры тромбинемии и фибринообразования (ТАТ, F1+2, Д-димер, PF4). В результате терапии с использованием НМГ как базового препарата по лабораторным данным отмечалось снижение уровня маркеров тромбофилии (ТАТ, Д-димер, F1+2), нормализация функции тромбоцитов.
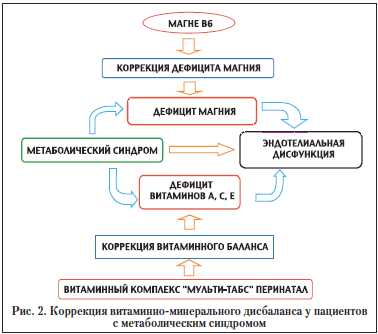
Как установлено, в условиях метаболического синдрома имеет место повреждение эндотелия сосудов с участием продуктов перикисного окисления липидов (ПОЛ), в частности, активных форм кислорода. Имеющиеся метаболические нарушения, высокое гидростатическое давление внутри сосудов при артериальной гипертонии, реакции системного воспалительного ответа, оксидативный стресс вызывают повреждение эндотелия и прогрессирование эндотелиопатии. Это дополнительно активирует систему гемостаза. Помимо вышесказанного, при метаболическом синдроме всегда наблюдается витаминно-минеральный дисбаланс: дефицит в организме витаминов А, Е и С, дефицит магния. Мы считаем патогенетически оправданным дополнительное назначение антиоксидантов, витаминов, полиненасыщенных жирных кислот, Магне В6, гипотензивной терапии при условии повышенного АД, фолиевой кислоты, особенно при наличии гипергомоцистеинемии и/или мутации МТНFR C677Т. Помимо этого, при мутации MTHFR С677Т и гипергомоцистеинемии – обязательно витамины В6, В12 (рис. 2).
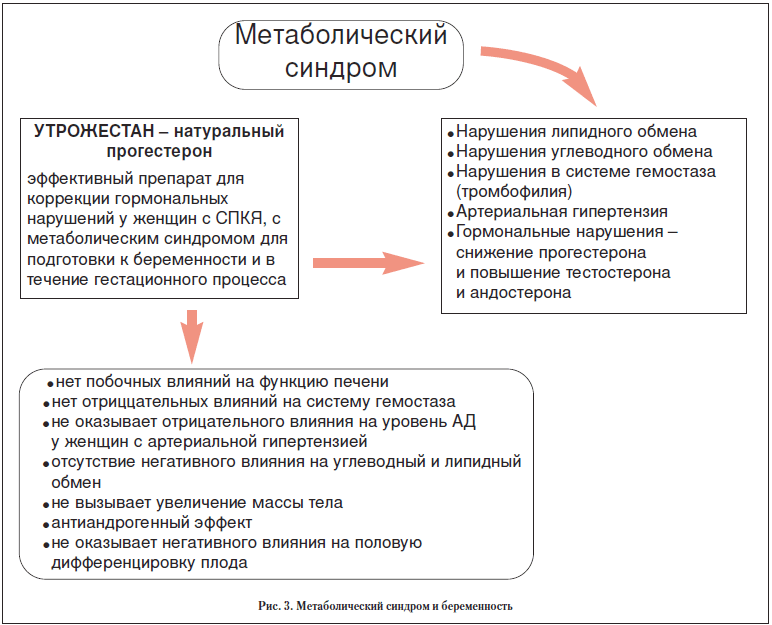
В случае выявления у женщин с МС дефицита прогестерона, а также неполноценности лютеиновой фазы (НЛФ) по тестам функциональной диагностики мы рекомендуем назначать Утрожестан у женщин с МС. Утрожестан – препарат, полностью идентичный натуральному прогестерону. Микронизированная форма обеспечивает максимальную биодоступность, как при пероральном, так и интравагинальном применении. При беременности наиболее широко применяется вагинальная форма (по 1 капсуле 2-3 раза в день) вследствие достаточно высокой абсорбции, первичного прохождения через эндометрий, высокой эффективности и удобства применения. Утрожестан обладает эффектом контроля за уровнем андрогенов. Утрожестан обладает способностью снижать активность андрогенов при гиперандрогении, способствует сохранению беременности и, что имеет принципиальное значение не влияет отрицательно на половую дифференцировку мозга плода. Это исключительно важно для дальнейшего правильного развития половой системы ребенка и его репродуктивного и психического здоровья во взрослом периоде жизни.
Утрожестан обладает регулирующей антигонадотропной активностью, не влияет на липидный профиль, артериальное давление (обладает легким гипотензивным действием за счет антиальдестеронового действия), метаболизм углеводов; не оказывает отрицательного влияния на систему гемостаза. Благодаря умеренному антиальдестероновому эффекту не вызывает задержку жидкости в организме, не вызывает увеличение массы тела. Основные метаболиты Утрожестана неотличимы от метаболитов эндогенного прогестерона, поэтому они не имеют непредсказуемых побочных эффектов. Все эти свойства Утрожестана важны в случае применения его у женщин с ожирением и метаболическим синдромом (рис. 3).
Утрожестан применяют в дозе 2-3 капсулы с 17 по 26 день цикла зачатия, при наступившей беременности – до 12-20 недели беременности в зависимости от показателей гормонов и клинической картины. При наличии диагностированной гиперандрогении – до 24 недели. Пациенткам с гиперандрогенией рекомендуется обязательное назначение Утрожестана с момента установления беременности или в циклах зачатия с целью купирования относительной гиперэстрогенемии, обусловленной периферической конверсией андрогенов в эстрогены.
Проведенное нами исследование женщин с метаболическим синдромом показало наличие мультигенной тромбофилии в 100% случаев, особенностью которой явилось превалирование в общей структуре генетических форм тромбофилии полиморфизма «675 4G/5G» гена PAI-1 (92,2%) – 71 человек. В 84,5% случаев выявлялась гомозиготная форма 4G/4G мутации гена PAI-1, гетерозиготная форма – в 15,5% случаев.
В контрольной группе у 7 (23,3%) беременных женщин выявлен полиморфизм гена PAI-1, в 100% случаев выявлялась только гетерозиготная форма полиморфизма гена PAI-1.
Второе место в структуре генетических форм тромбофилий занимает полиморфизм «807C/T» в гене гликопротеина Gp-Ia тромбоцитов (80,5%), третье место – полиморфизм в гене тканевого активатора плазминогена – 77,9 %, далее – полиморфизм «I/D» в гене АПФ – 64,9%, полиморфизм «455 G/A» в гене фибриногена – 62,3%, мутация МТНFR C677Т – 61%, полиморфизм «1565 T/C» в гене гликопротеина Gp-IIIa тромбоцитов – 51, 9%, полиморфизм «1166 А/С» в гене рецептора ангиотензина II 1 типа – 38,9%, мутация FV Leiden- 28,6%, мутация протромбина G20210A в 0% случаев.
У 10 (14,3%) женщин с метаболическим синдромом нами было выявлено сочетание АФС с генетическими формами тромбофилии. В контрольной группе не было выявлено приобретенной и комбинированной форм тромбофилии.
У женщин во II группе уровень маркеров реальной тромбофилии (ТАТ, Д-димер) значительно превышали таковые по сравнению с пациентами I группы, получавшими антитромботическую профилактику, начиная с фертильного цикла. Лучшие исходы беременности были у пациенток I группы. Раннее применение НМГ и витаминов наряду с антиоксидантами препятствовало усугублению гестоза и позволяло пролонгировать беременность и улучшить перинатальные показатели.
Следует отметить, что гестоз у женщин в I группе развивался на более поздних сроках беременности по сравнению с беременными II группы. У 15 (46,9%) женщин I группы развился гестоз легкой степени, у 4 (12,5%) – средней степени тяжести. Тяжелых форм гестоза у женщин I группы не было.
В то же время во II группе позднее начало терапии с использованием антикоагулянтов в условиях состоявшегося тяжелого гестоза и ФПН было малоэффективно.
Позднее начало патогенетически обоснованной терапии на фоне начавшегося гестоза у 11 (24,4%) пациенток II группы привело к развитию гестоза легкой степени, у 24 (53,3%) – средней степени тяжести, 10 (22,2%) – тяжелых форм гестоза.
Патогенетически обоснованная профилактика с использованием НМГ, витаминов и антиоксидантов позволила пролонгировать беременность у всех женщин I группы.
У 5 пациенток II группы в тех случаях, когда терапия была начата поздно, избежать потерь плода не удалось. В одном случае была антенатальная гибель одного плода из двойни.
У 73 женщин беременность завершилась рождением живого ребенка. 60 беременных (77,9%) были родоразрешены путем операции кесарево сечение. Показанием к операции кесарево сечение явилась разнообразная акушерская патология. Причем в I группе показанием к операции были: отягощенный акушерско-гинекологический анамнез (бесплодие в анамнезе, синдром потери плода в анамнезе), усугубление гестоза. Показания для оперативного родоразрешения во II группе – усугубление гестоза, нарастание тяжести ФПН, не поддающиеся медикаментозной коррекции. В 22,1% (17) случаев роды были преждевременными (34-36 недель беременности).
На фоне проводимой антитромботической профилактики НМГ ни в одном из случаев не наблюдалось послеоперационных тромбоэмболических осложнений.
Согласно нашим данным, назначение антикоагулянтной и/или антиагрегантной терапии у женщин с метаболическим синдромом при наличии генетической формы тромбофилии и/или с АФС уже в фертильном цикле улучшает прогноз во время беременности. Патогенетически обоснованная профилактика с использованием низкомолекулярного гепарина, витаминов и антиоксидантов у пациенток с метаболическим синдромом и мультигенной тромбофилией с ранних сроков беременности позволила улучшить течение гестационного процесса и перинатальные исходы у беременных с метаболическим синдромом, имеющих в анамнезе СПП, гестоз в предшествующие беременности.
Чем раньше начата противотромботическая терапия, тем лучше исходы беременности.
Основные принципы профилактики акушерских осложнений у женщин с метаболическим синдромом и комбинированной тромбофилией:
1. Снижение массы тела.
2. Начало терапии с фертильного цикла.
Планирование беременности при тромбофилии
Тромбофилия – это заболевание, при котором существенно повышается свертываемость крови, что влечет за собой риск развития тромбоза.
Сами по себе тромбы при нормальном стечении обстоятельств защищают организм человека, а не калечат его: если сосуд повреждается, образуется тромб, который закупоривает поврежденный сосуд. Но при тромбозе тромбы могут образовываться и в совершенно здоровых сосудах, перекрывая приток крови и питательных веществ к тканям.
Женщина может болеть тромбофилией и планировать стать матерью. Это вполне естественно. Но не так уж и редко болезнь развивается во время беременности.
В обоих случаях тромбофилия может стать опасной как для плода, так и для беременной женщины, поэтому необходимо контролировать состояние крови, чтобы вовремя отследить развитие болезни и начать лечение как можно раньше.
Типы тромбофилий
Типы заболевания представлены в таблице.
| Тип заболевания | Причины |
|---|---|
| Приобретенная | Сопутствующие заболевания — полицитемия, болезни сердца, прием гормональных препаратов, перенесенные инфекции |
| Генная | Наследственные патологии и мутации, влияющие на свертываемость крови. Возникает на генном уровне и выражается врожденным повышением факторов свертываемости крови. Часто встречается у близких родственниц |
| Иммунная | Аутоиммунные нарушения, при которых в организме матери вырабатываются антитела к ее собственным тканям, и аллоиммунные, проявляющиеся выработкой антител к тканям плода |
| Сосудистая | Атеросклероз, васкулит, варикоз, диабетические поражения сосудов |
| Гемодинамическая | Нарушение движения крови по сосудам, вызванные снижением АД и повышенной вязкостью крови |
| Гематогенная | Приобретенные нарушения кровесвертывающей, противосвертывающей и фибринолитических систем |
Заболевание может развиваться в тяжелой форме. Чаще всего так случается из-за врожденных патологий (например, склонности к образованию тромбов).
Еще один фактор риска – возраст: у женщин старше 35 лет, которые рожают впервые или уже имеют много детей, тромбофилия вне зависимости от типа развивается тяжелее. Провоцирующим фактором могут стать аборты, тяжелые хронические болезни, привычные выкидыши.
Клинические проявления
Зачастую, люди, страдающие тромбофилией, не предъявляют никаких жалоб и не отмечают какие-либо изменения в состоянии своего здоровья.
Это связано с тем, что для данной патологии характерно длительное течение и плавность нарастания клинических проявлений.
Иногда генетическая тромбофилия проявляет свои симптомы через несколько лет после того, как были выявлены генетические маркеры тромбофилии.
Только при образовании тромба у больных появляется клиническая симптоматика. Степень выраженности проявления симптомов определяется локализацией тромба и степенью закупорки просвета сосуда:
- При появлении кровяных сгустков в сосудах артериального русла может возникнуть артериальный тромбоз. На фоне этого возможно развитие ишемического инсульта и приступов острой коронарной недостаточности у молодых людей. В случае формирования тромба в плацентарных сосудах возможны выкидыши и гибель плода внутриутробно.
- При венозном тромбозе нижних конечностей возникает широкий спектр клинических проявлений. Появляется ощущение тяжести в ногах, распирающая боль в области голени, выраженные отеки нижних конечностей и трофические изменения кожных покровов.
- При локализации тромба в мезентериальных сосудах возникает острая кинжальная боль, тошнота, рвота и послабление стула.
- Для тромбоза печеночных вен характерна интенсивная боль в эпигастральной области, неукротимая рвота, отеки нижних конечностей, увеличение живота.
