Еще раз об анемии… Точная дифференциальная диагностика – залог успешного лечения
Все анемии являются вторичными и обычно представляют собой проявление основного заболевания. Поэтому дифференциальную диагностику анемии можно условно разделить на 2 этапа. На начальном этапе диагностического поиска основной целью является определение так называемого патогенетического варианта анемии, т.е. основного механизма, который обусловил снижение уровня гемоглобина в данном конкретном случае. Фактически речь идет о синдромной диагностике, так как каждый из патогенетических вариантов анемии представляет собой лишь отдельный синдром (железодефицитной анемии, гемолитической анемии и т.д.). Этот этап диагностики осуществляет лаборатория.
Следующий этап диагностического поиска – прерогатива лечащего врача. После определения патогенетического варианта анемии задачей врача является диагностика патологического процесса, лежащего в основе данного анемического синдрома, т.е. выявление причины анемии у конкретного больного.
Распознавание патогенетического варианта, как мы уже отметили, базируется на данных лабораторного исследования и зависит во многом как от уровня и качества этих исследований, так и от правильной трактовки полученных данных.
В большинстве случаев определение патогенетического варианта анемии возможно на основании комплекса рутинных лабораторных исследований, которые считаются обязательными для проведения дифференциального диагноза при анемии.
К таким исследованиям относятся следующие:
биохимическое исследование сыворотки крови на предмет содержание железа общей железосвязывающей способности сыворотки, а также уровня ферритина (Табл.2);
Гемограмма с гематологического анализатора
Дети до 2 лет: 0,4-1,0 мг/л (7 – 18,0 мкмоль/л)
Итак, на первом этапе в лаборатории следует повести анализ образца на гематологическом анализаторе. При выявлении снижения гемоглобина необходимо прежде всего определить характер анемии: гипо-, нормо- или гиперхромный. Критерием является величина МСН, отражающая, как известно, среднее содержание гемоглобина в эритроците.
Если среднее содержание гемоглобина в эритроцитах (МСН) превышает 31 пг — анемию относят к гиперхромному типу. Гиперхромные анемии, как правило, являются макроцитарными (MCV > 95 фл). Значение MCHC тоже не выходит за пределы нормы, а снижение гемоглобина обычно обусловлено резким снижением количества эритроцитов с преобладанием фракции клеток с большим объемом (макроцитов). К данному типу анемий относят В12-дефицитную, фолиеводефицитную и аутоиммунную гемолитическую анемии.
Нормохромные анемии в большинстве случаев являются и нормоцитарными, т.е. все эритроцитарные индексы находятся в пределах нормы (см. Табл. 1). Причиной снижения гемоглобина в этих случаях является снижение общего количества эритроцитов. В группу нормохромно-нормоцитарных анемий входят анемии при острой кровопотере, а также разнообразные гемолитические анемии и анемии при костномозговой недостаточности.
МСН является аналогом цветового показателя (ЦП),который вычисляют в тех случаях, когда в лаборатории нет гематологического анализатора и подсчет эритроцитов осуществляется в камере Горяева. Нормальные значения ЦП находятся в пределах 0,85 – 1,0. Однако, в случае ошибочного подсчета числа эритроцитов, в частности занижения их количества (что при ручном подсчете случается достаточно часто!), цветовой показатель может оказаться близким к единице. Это может служить источником серьезной ошибки на начальном этапе диагностического поиска, которая повлечет за собой назначение необоснованных исследований, и, как следствие, существенно усложнит дифференциальную диагностику.
Высокая точность и воспроизводимость результатов, возможность подсчета большого количества клеток и расчетных параметров на гематологических анализаторах позволяют уже на первом этапе анализа с высокой вероятностью предположить у пациента определенный патогенетический вариант анемии и четко определить необходимые дополнительные исследования, которые окажутся достаточными для постановки точного диагноза. Так, при выявлении у пациента гипохромно-микроцитарной анемии, наиболее вероятный диагноз — железодефицитная анемия. Для окончательного подтверждения диагноза в данном случае следует провести исследование биохимических показателей обмена железа. При гиперхромно-макроцитарной анемии с вероятностью близкой к 95% можно заподозрить В12-дефицитную или фолиеводефицитную анемию. Поэтому дальнейшая тактика лаборатории на пути дифференциальной диагностики – определение количества ретикулоцитов и исследование костного мозга.
Данные клинических и лабораторных исследований при наследственных сидеробластных анемий
В большинстве случаев клиническая картина сидеробластной анемии, сцепленной с Х-хромосомой, не отличается от таковой при анемии с аутосомным типом наследования или других врожденных форм. Тяжелая анемия, как правило, диагностируется в младенчестве или раннем детстве. При менее выраженных проявлениях анемического синдрома или бессимптомном течении заболевание выявляется обычно у взрослых или даже пожилых больных.
Наряду с анемическим синдромом у всех больных определяются признаки избытка железа в организме, которые получили специальное название: синдром эритропоэтигеского гемохроматоза. Проявления этого синдрома достаточно разнообразны. Чаще всего определяются умеренная гепатомегалия и спленомегалия. Функция печени в большинстве случаев нарушена незначительно или не страдает вообще. При биопсии печеночной ткани определяются депозиты железа в гепатоцитах. У некоторых больных старше 30-40 лет при гистологическом исследовании находят признаки микронодулярного цирроза печени, протекающего, как правило, доброкачественно.
На фоне гемохроматоза поджелудочной железы могут определяться сахарный диабет или нарушения толерантности к глюкозе. Редко при объективном обследовании выявляется пигментация кожных покровов. Наиболее опасными проявлениями синдрома эритро-поэтического гемохроматоза являются тяжелые нарушения сердечного ритма и сердечная недостаточность, которые развиваются, как правило, на поздних этапах заболевания. В тяжелых случаях у детей может наблюдаться задержка роста и развития.
В анализе крови определяется анемия различной степени тяжести. При тяжелой анемии обычно имеются гипохромия, микроцитоз, анизо- и пойкилоцитоз, реже мишеневидные клетки и единичные сидероциты. При менее тяжелых формах анемии в мазке могут выявляться две популяции клеток: гипохромные микроциты и нормальные эритроциты. На гистограмме эритроцитов при этом образуется двухфазная кривая, отражающая различия в размерах эритроцитов. Уровень лейкоцитов и тромбоцитов обычно в норме, но при развитии гиперспленизма может снижаться. Количество ретикулоцитов в большинстве случаев в норме или незначительно повышено.
В миелограмме выявляется гиперплазия эритроидного ростка на фоне нормобластического типа кроветворения и повышенное количество сидеробластов. В редких случаях (при сопутствующем дефиците фолиевой кислоты) может определяться мегалобластический тип кроветворения.
При биохимическом исследовании обычно выявляется незначительная гипербилирубинемия, повышение уровня ферритина и снижение уровня трансферрина, и увеличение его сатурации. При анемии, сцепленной с Х-хромосомой, имеется снижение активности АЛК-синтетазы.
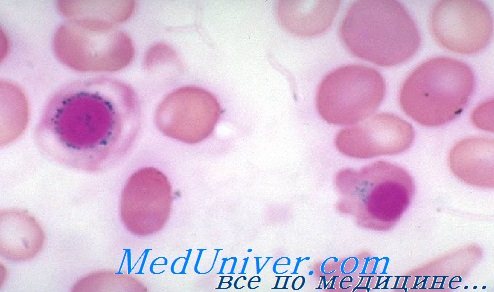
Мазок при сидеробластной анемии
У больных с синдромом Пирсона диагностируется рефрактерная сидеробластная анемия, которая сочетается с признаками экзокринной недостаточности поджелудочной железы, эпизодами молочнокислого ацидоза и прогрессирующей почечной и печеночной недостаточностью. Анемия выявляется, как правило, после рождения и носит нормоцитарныи или макроцитарный характер. Уровень ретикулоцитов чаще всего снижен. В большинстве случаев имеются нейтропения и тромбоцитопения различной степени тяжести. При электрофорезе гемоглобина обычно определяется повышение уровня Hb F. Костный мозг гиперклеточный или нормоклеточный, выявляются кольцевые сидеробласты.
Причины
Врожденная сидеробластная анемия
Врожденные СБА связаны с мутациями в генетическом материале. Они различаются по типу наследования и патогенетическому механизму:
- Х-сцепленные сидеробластные анемии. Один вариант обусловлен дефектами гена ALAS2 ‒ синтазы дельта-аминолевуленовой кислоты II типа (локус Хр11.21). Другой тип болезни связан с трансгенациями hABC7 (Xp13.1-q13.3), кодирующего белок, участвующий в транспорте гема.
- Аутосомно-рецессивная сидеробластная анемия. Генетически гетерогенная группа. Может возникать при дефекте гена WFS1 (4p16.1), отвечающего за экспрессию трансмембранного белка вольфрамина. В этом случае СБА диагностируется в рамках синдрома Вольфрама (DIDMOAD). Другая форма развивается при дефектах в гене SLC25A38, кодирующем белок-транспортер глицина, необходимый для синтеза гема.
- Митохондриальная цитопатия. Вызвана делециями митохондриальной ДНК, клинически проявляется развитием синдрома Пирсона.
- Спорадические сидеробластные анемии. Обусловлены появлением вновь возникших генетических мутаций, которые отсутствуют у родителей и других членов семьи.
Приобретенная сидеробластная анемия
Идиопатические (первичные) СБА ‒ рефрактерные анемии с кольцевыми сидеробластами ‒ рассматриваются как разновидность миелодиспластического синдрома (МДС) и занимают в его структуре 5-15%. Чаще возникают как следствие лучевой или цитостатической терапии, проводимой по поводу коллагенозов, гемобластозов, различных онкопроцессов. Риск развития МДС повышен у курильщиков, лиц, контактирующих с химическими веществами (бензином, растворителями, инсектицидами).
Вторичная сидеробластная анемия может быть этиологически связана со следующими факторами:
- прием антибактериальных и туберкулостатических препаратов (хлорамфеникол, линезолид, изониазид, циклосерин);
- интоксикация свинцом;
- хронический алкоголизм;
- нарушение баланса витаминов и микроэлементов: дефицит пиридоксина (витамина В6), недостаток меди, избыток цинка;
- коллагенозы;
- болезни крови (полицитемия, гемолитическая анемия).
Прогноз и профилактика
Хроническая интоксикация имеет нeблагоприятный прогноз
Прогноз течения болезни зависит от причин, которые ее вызвали. В случаях острых отравлений токсическими веществами или алкоголем сидеробластная анемия зачастую проходит без особенных последствий для здоровья.
При хронических интоксикациях на работе прогноз не так благоприятен, потому что при постоянном воздействии повреждающего здоровье фактора защитные резервы организма истощаются. Работник может перестать контактировать с вредными веществами, но красный костный мозг к тому моменту иногда бывает серьезно поврежден, потому болезнь продолжается.
Если же причиной является наследственная аномалия кроветворения, то сидеробластная анемия будет сопровождать человека на протяжении всей жизни, возможны только изменения по форме тяжести заболевания. При своевременном лечении пациенты с наследственной сидеробластной анемией имеют легкую форму болезни, которая не мешает их нормальной жизни.
В случаях сильного витаминного дефицита достаточно устранить его и улучшить питание, и болезнь оказывается навсегда устранена, однако такая причина сидеробластной анемии встречается крайне редко.
Бесконтрольный прием препаратов железа недопустим!
К основным направлениям профилактики сидеробластной анемии относятся:
- Недопущение самолечения антибиотиками и другими сильнодействующими препаратами. Лекарства, которые могут повлиять на функции красного костного мозга, должны использоваться под контролем показателей крови.
- Контроль над количеством потрeбляемого алкоголя. При наличии наследственной предрасположенности алкогольные напитки не должны употрeбляться вовсе.
- Использование индивидуальных средств защиты на работе, если она предполагает контакт с опасными химическими веществами, соблюдение правил безопасности.
- Регулярное прохождение медицинских осмотров (по общему анализу крови врач легко заподозрит сидеробластную анемию и вовремя назначит лечение).
- Отдых в экологически чистых местностях. Особенно это важно при жизни в крупных городах с большим количеством автомобилей, отравляющих воздух.
- Недопущение приема лечебных доз препаратов железа без назначения врача. Железо часто содержится в составе поливитаминных комплексов, их самостоятельный прием более безопасен из-за того, что там оно будет в поддерживающих здоровье дозах.
Благоприятное влияние оказывает диета
Рекомендовано сбалансированное питание, богатое источниками витамина В₆:
- фисташки, семечки подсолнечника;
- отруби, хлеб из цельнозерновой муки;
- чеснок;
- орехи (фундук, грецкие);
- горбуша, семга;
- гречневая крупа, фасоль;
Сидеробластная анемия встречается значительно реже обычной железодефицитной, но является более тяжелой, так как может наносить здоровью серьезный вред из-за повреждения внутренних органов. Нужно помнить, что самостоятельно отличить разные виды анемий невозможно, потому необходимо обратиться к врачу при появлении первых симптомов болезни.
Признаки и симптомы патологии
Симптоматика заболевания характерна для всех видов и форм анемий:
- Анемический синдром (бледность кожных покровов, сухость слизистых, ломкость ногтевых пластин, головокружение, снижение памяти).
- Нарушения в работе сердца и сосудов (гипотензия, тахикардия, появление систолического шума над верхушкой сердца).
- Расстройство пищеварения (снижение аппетита, искажения вкусовых свойств, нарушения глотания, частые запоры и диарея).

Симптомы патологического состояния в детском возрасте проявляются отставанием в физическом развитии и неуспеваемостью в учебе
При врачебном осмотре отмечается увеличение печени и селезенки, что обуславливается отложением избыточного количества железа (гемосидероз). Постепенное скопление микроэлемента в печени приводит к развитию цирроза, поэтому на последней стадии заболевания орган уменьшается в размерах, а при ультразвуковой диагностике выявляется уплотнение тканей.
В большинстве случаев, гемосидероз поражает другие системы организма. Так, при накоплении железа в половых органах у мужчин, происходит снижение количества вырабатываемого тестостерона, что приводит к развитию евнухоидизма. При поражении поджелудочной железы развивается сахарный диабет, который может осложниться диабетической комой.
Сидеробластические анемии, вызванные интоксикацией тяжелыми металлами, в клинической картине проявляются острыми болями в брюшной полости, и поражением периферической нервной системы. Очень часто данных пациентов направляют в хирургические отделения с подозрением на острый воспалительный процесс органов брюшной полости.
Читайте также:
Причины анемии у мужчин
Лечение анемии у пожилых людей
Прогноз. Профилактика
Прогноз будет хорошим, если выявить анемию на латентной стадии, правильно определить причину и назначить адекватное лечение.
Неблагоприятным прогноз может быть при анемиях на фоне онкозаболевания и генетических нарушений, так как они плохо поддаются лечению. Например, при большой β- талассемии, если болезнь не диагностировать в первые месяцы жизни ребёнка и не начать терапию, средняя продолжительность жизни составит около четырёх лет.
Первичная профилактика ЖДА и латентного дефицита железа — это адекватное, сбалансированное питание.
Профилактические дозы препаратов железа рекомендуется назначать:
- детям на грудном и смешанном вскармливании, начиная с четырёхмесячного возраста и до введения прикорма;
- недоношенным детям на грудном вскармливании, начиная с первого месяца жизни и до перехода на искусственное вскармливание молочными смесями, обогащёнными железом, или до введения прикорма;
- детям и взрослым с рецидивирующими кровотечениями;
- вегетарианцам и веганам;
- донорам, которые регулярно сдают кровь.
Профилактика анемии также включает в себя регулярные обследования у терапевта: если нет хронических заболеваний, то нужно приходить на профилактические осмотры 1 раз в год и делать клинический минимум анализов и обследований (общий и биохимический анализы крови).
Вторичная профилактика проводится пациентам, которые прошли основной курс терапии, у них восстановились показатели крови, но при этом сохраняются причины, которые могут привести к рецидиву гипохромной анемии: обильные менструации, фибромиома матки, рецидивирующий геморрой и др. [3] Необходимость профилактического приёма препаратов железа, а также дозировки определяет лечащий врач.
Все пациенты с гипохромной анемией средней и тяжёлой степени должны стоять на диспансерном учёте у терапевта по месту жительства. Кратность посещения врача и объём обследований определяется индивидуально для каждого пациента, учитывая степень тяжести анемии и наличие сопутствующей патологии. Если пациента ничего не беспокоит, рекомендуется приходить к врачу 2 раза в год.
При выявлении анемии по результатам анализа не следует заниматься самолечением, нужно сразу обратиться к врачу и выяснить основную причину. Во многих случаях требуется лечение первичного заболевания, а не просто приём препаратов железа.
