Еще раз об анемии… Точная дифференциальная диагностика – залог успешного лечения
Все анемии являются вторичными и обычно представляют собой проявление основного заболевания. Поэтому дифференциальную диагностику анемии можно условно разделить на 2 этапа. На начальном этапе диагностического поиска основной целью является определение так называемого патогенетического варианта анемии, т.е. основного механизма, который обусловил снижение уровня гемоглобина в данном конкретном случае. Фактически речь идет о синдромной диагностике, так как каждый из патогенетических вариантов анемии представляет собой лишь отдельный синдром (железодефицитной анемии, гемолитической анемии и т.д.). Этот этап диагностики осуществляет лаборатория.
Следующий этап диагностического поиска – прерогатива лечащего врача. После определения патогенетического варианта анемии задачей врача является диагностика патологического процесса, лежащего в основе данного анемического синдрома, т.е. выявление причины анемии у конкретного больного.
Распознавание патогенетического варианта, как мы уже отметили, базируется на данных лабораторного исследования и зависит во многом как от уровня и качества этих исследований, так и от правильной трактовки полученных данных.
В большинстве случаев определение патогенетического варианта анемии возможно на основании комплекса рутинных лабораторных исследований, которые считаются обязательными для проведения дифференциального диагноза при анемии.
К таким исследованиям относятся следующие:
биохимическое исследование сыворотки крови на предмет содержание железа общей железосвязывающей способности сыворотки, а также уровня ферритина (Табл.2);
Гемограмма с гематологического анализатора
Дети до 2 лет: 0,4-1,0 мг/л (7 – 18,0 мкмоль/л)
Итак, на первом этапе в лаборатории следует повести анализ образца на гематологическом анализаторе. При выявлении снижения гемоглобина необходимо прежде всего определить характер анемии: гипо-, нормо- или гиперхромный. Критерием является величина МСН, отражающая, как известно, среднее содержание гемоглобина в эритроците.
Если среднее содержание гемоглобина в эритроцитах (МСН) превышает 31 пг — анемию относят к гиперхромному типу. Гиперхромные анемии, как правило, являются макроцитарными (MCV > 95 фл). Значение MCHC тоже не выходит за пределы нормы, а снижение гемоглобина обычно обусловлено резким снижением количества эритроцитов с преобладанием фракции клеток с большим объемом (макроцитов). К данному типу анемий относят В12-дефицитную, фолиеводефицитную и аутоиммунную гемолитическую анемии.
Нормохромные анемии в большинстве случаев являются и нормоцитарными, т.е. все эритроцитарные индексы находятся в пределах нормы (см. Табл. 1). Причиной снижения гемоглобина в этих случаях является снижение общего количества эритроцитов. В группу нормохромно-нормоцитарных анемий входят анемии при острой кровопотере, а также разнообразные гемолитические анемии и анемии при костномозговой недостаточности.
МСН является аналогом цветового показателя (ЦП),который вычисляют в тех случаях, когда в лаборатории нет гематологического анализатора и подсчет эритроцитов осуществляется в камере Горяева. Нормальные значения ЦП находятся в пределах 0,85 – 1,0. Однако, в случае ошибочного подсчета числа эритроцитов, в частности занижения их количества (что при ручном подсчете случается достаточно часто!), цветовой показатель может оказаться близким к единице. Это может служить источником серьезной ошибки на начальном этапе диагностического поиска, которая повлечет за собой назначение необоснованных исследований, и, как следствие, существенно усложнит дифференциальную диагностику.
Высокая точность и воспроизводимость результатов, возможность подсчета большого количества клеток и расчетных параметров на гематологических анализаторах позволяют уже на первом этапе анализа с высокой вероятностью предположить у пациента определенный патогенетический вариант анемии и четко определить необходимые дополнительные исследования, которые окажутся достаточными для постановки точного диагноза. Так, при выявлении у пациента гипохромно-микроцитарной анемии, наиболее вероятный диагноз — железодефицитная анемия. Для окончательного подтверждения диагноза в данном случае следует провести исследование биохимических показателей обмена железа. При гиперхромно-макроцитарной анемии с вероятностью близкой к 95% можно заподозрить В12-дефицитную или фолиеводефицитную анемию. Поэтому дальнейшая тактика лаборатории на пути дифференциальной диагностики – определение количества ретикулоцитов и исследование костного мозга.
Норма и патология
Эритроциты позволяют поддерживать жизнедеятельность человеческого организма. В норме их размеры составляют 80-100 фл.
В зависимости от данного показателя, различают:
Микроцитарную анемию (микроцитоз) при которой размеры эритроцитов менее 80 фл.
Макроцитарная анемия, при которой размеры эритроцитов превышают 100 фл.
Если размеры эритроцитов сохраняются в пределах нормы, то врачи говорят о нормоцитозе.
Цветовой показатель крови имеет немаловажное значение при диагностике различных заболеваний. Анемия может быть гипохромной, гиперхромной и нормохромной. За окраску крови отвечает гемоглобин, который входит в состав эритроцитов. Если его в крови недостаточно, то микроцитоз сопровождается гипохромией. Такое состояние носит название микроцитарной анемии.
Развитие анемии
Со временем дефицит железа прогрессирует, течет долгие годы латентно, а затем, после полного истощения запасов железа в депо, развивается ЖДА. Основной механизм развития анемии — нарушение гемоглобинообразования в эритрокариоцитах костного мозга. В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого гемоглобинизация эритронормобластов запаздывает по сравнению с процессом обратного развития ядерных структур. Поскольку синтез гемоглобина из-за дефицита железа страдает в большей степени, чем образование эритроцитов, для ЖДА при сравнительно умеренном снижении числа эритроцитов свойственно более выраженное падение содержания в них гемоглобина, что проявляется гипохромией эритроцитов и развитием гипохромной микроцитарной анемии.
Второй патологический механизм, который имеет место в условиях дефицита железа, — это снижение образования других важнейших белков, участвующих в накоплении и транспорте кислорода. Уменьшается содержание миоглобина в поперечнополосатой мускулатуре. Нарушение образования цитохромов и каталаз приводит к угнетению энергетического обмена всех клеток организма, при этом в основном страдают быстро делящиеся ткани (кожа и слизистые оболочки).
В зависимости от причин, вызывающих дефицит железа, выделяется пять групп ЖДА:
1) хронические постгеморрагические ЖДА;
2) ЖДА, связанные с нарушением всасывания и поступления железа с пищей;
3) ЖДА, связанные с недостаточным исходным уровнем железа в организме (чаще у детей);
4) ЖДА, обусловленные повышением потребности организма в железе (без кровопотери);
5) ЖДА, связанные с нарушением транспорта железа.
- мышечную слабость, не соответствующую степени анемии;
- извращение вкуса , в виде стремления есть несъедобные вещества (мел, уголь, глину), сырые продукты,крупы, тесто, сырой мясной фарш), а также пристрастие к необычным запахам (керосина, мазута, бензина, ацетона, гуталина,нафталина, выхлопных газов машин);
- выпадение волос и сухость кожи с образованием трещин, особенно часто в уголках рта (ангулярный стоматит);
- изменения ногтей: ломкость, появление исчерченности, вогнутости(койлонихии);
- болезненность и очаговое покраснение слизистой языка с атрофией сосочков («географический язык»);
- дисфагия, характеризующаяся затруднением глотания сухой пищи и развитием болезненных спазмов пищевода (синдром Пламмера—Вильсона);
- дизурические расстройства (недержание мочи, ночной энурез).
Патогенез анемии
У каждой разновидности анемии имеется своя причина, но их патогенез очень схож, поэтому рассмотрим механизм развития часто встречающихся анемий.
Патогенез железодефицитной анемии складывается из двух механизмов:
- Встречается при всех анемиях: гипоксические изменения (нарушение функции тканевого дыхания) в тканях и органах, возникающие в результате снижения количества гемоглобина в организме. Клинические проявления гипоксических изменений представлены общей слабостью, сонливостью, снижением умственной работоспособности и физической выносливости, шумом в ушах, головокружениями, обморочными состояниями, одышкой при нагрузке, сердцебиением, бледностью.
- Присущ исключительно железодефицитной анемии: замедление активности ферментов, содержащих железо, участвующих в тканевом дыхании клеток. Основой формирования железодефицитной анемии является дефицит железа в организме. Железо является каркасом для образования молекул гемоглобина, а именно его железосодержащей части — гема.
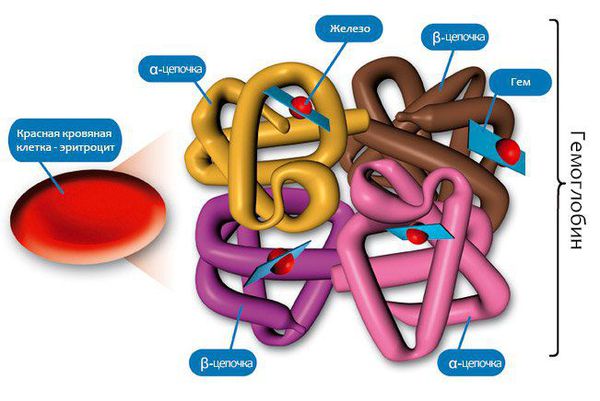
Дефицит железа, как и другие анемии в организме, проходит три стадии:
- Прелатентная — скрытая форма, так как эта стадия не имеет клинических проявлений.
- Латентная — нарушается тканевое дыхание и ферментативная активность.
- Анемия — снижение общего количества гемоглобина или гематокрита, уменьшение количества эритроцитов [1] .
Патогенез В12-дефицитной анемии
Сущность В12 дефицитной анемии заключается в нарушении процесса созревания красных кровяных клеток вследствие дефицита витамина В12 или В9 (фолиевой кислоты).
При дефиците витамина В12 прежде всего страдают: костный мозг, головной мозг и эпителий желудочно-кишечного тракта. В красном ростке кроветворения появляется мегалобластный тип кроветворения: возникает дефект синтеза ДНК, в результате чего формируются очень крупные клетки — мегалобласты, а из них мегалоциты; нарушается синхронность созревания ядра и цитоплазмы эритроцитов; красные кроветворные клетки гибнут рано. В это же время снижается гранулоцитопоэз (образование гранулоцитов, которые представляют собой самую многочисленную группу лейкоцитов) и тромбоцитопоэз (образование тромбоцитов).
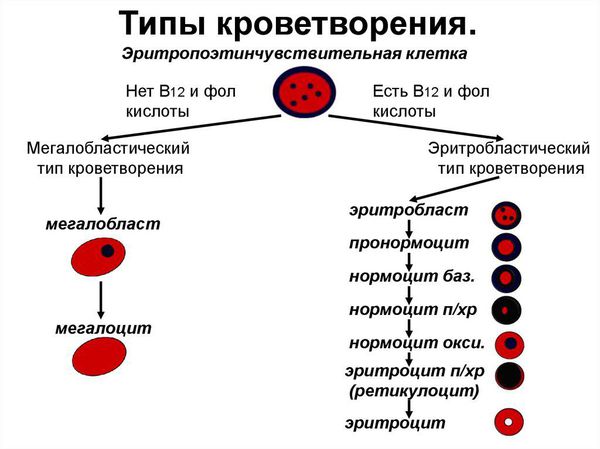
При недостатке витамина В12 нарушается обмен жирных кислот и накапливаются нейротоксичные метилмалоновая и пропионовая кислоты. Синтез миелина (вещества, образующего миелиновую оболочку нервных волокон) нарушается. Повреждаются задние и боковые спинномозговые столбы [3] .
Чем опасна анемия: ключевые осложнения
В зависимости от вида анемии последствия могут существенно различаться. Среди основных проблем различают хроническую усталость с общей слабостью, сонливостью, упадком сил и рассеянностью, трудностями при выполнении повседневных дел и занятий спортом.
Нарушения иммунной системы связаны с влиянием гипоксии на иммунную систему. Это делает людей более восприимчивыми к хроническим инфекциям.
Тяжелые анемии повышают риск осложнений со стороны сердца, сосудов и респираторного тракта, могут возникать аритмии и недостаточность сердца.
Анемия может серьезно ухудшить состояние при беременности: возможно нарушение внутриутробного развития плода, проблемы в родах и после них. Также возможна послеродовая депрессия, могут быть недоношенность, сниженная масса тела и анемии младенцев.
На фоне анемии возможно развитие синдрома беспокойных ног – это связано с поражением нервной системы, что ведет к тому, что нужно постоянно шевелить ногами. Проблема лечится приемом препаратов железа.
Профилактика гемолитических анемий

Профилактика гемолитических анемий подразделяется на первичную и вторичную. Первичная профилактика подразумевает меры, предотвращающие возникновение гемолитических анемий, а вторичная – снижение клинических проявлений уже существующего заболевания.
Первичная профилактика идиопатических аутоиммунных анемий не производится за отсутствием причин таковых.
