ГИПОПЛАСТИЧЕСКАЯ АНЕМИЯ
Гипопластическая анемия (греч. hypo- + plasis формирование, образование; анемия; син.: апластическая анемия, арегенераторная анемия, геморрагическая алейкия, миелопарез, миелофтиз, панмиелофтиз, прогрессирующая гипоцитемия) — заболевание системы крови, характеризующееся угнетением кроветворной функции костного мозга и проявляющееся недостаточным образованием эритроцитов, лейкоцитов и тромбоцитов (пангемоцитопенией) или только одних эритроцитов (парциальная Гипопластическая анемия, эритробластофтиз).
Различают врожденные (конституциональные) и приобретенные формы Гипопластической анемии. Врожденные Гипопластические анемии встречаются сравнительно редко. В зависимости от характера угнетения кроветворения выделяют формы с поражением всех трех ростков (истинная Г. а.) или только эритропоэза (парциальная Г. а.). Иногда выделяют Г. а. с гемолитическим компонентом, но некоторые авторы считают, что она представляет собой гипопластическую стадию пароксизмальной ночной гемоглобинурии (см. Гемолитическая анемия).
Апластичная анемия: этиология
Согласно происхождению, выделяют врождённую и приобретённую анемию. Первая развивается вследствие хромосомных мутаций, вторая – под воздействием химических веществ, излучения, инфекций. Специалисты считают, что угнетение кроветворения костного мозга может быть инициировано появлением в нём и в крови цитотоксических Т-лимфоцитов. Они производят ФНО (внеклеточный белок) и интерферон “y”, которые подавляюще воздействуют на ростки кроветворения. Причина запуска механизма может крыться в:
- Воздействии ионизирующего излучения или химических веществ в виде ароматических соединений, мышьяка, пестицидов;
- Попадании в организм инфекционных агентов (возбудители гепатитов “D”, “B”, цитомегаловируса, ДНК-содержащего вируса Эпштейна-Барр);
- Приёме миелотоксических препаратов при прохождении курса лечения транквилизаторами, противосудорожными, антитиреоидными и антиопухолевыми средствами;
- Развитии ряда аутоиммунных процессов (красная системная волчанка, поражение соединительной ткани – синдром Шегрена).
В 50% случаев причину развития патологии установить не удаётся. Такая форма апластической анемии называется идиопатической.
Апластическая и гипопластическая анемия – в чем разница?
Между апластической и гипопластической анемией имеются ряд различий, но они не слишком существенные. Поэтому если врач видит в карте пациента диагноз «гипопластическая анемия», он рассматривает его как «апластическая анемия».
Тем не менее, следует внести некоторые уточнения:
Апластическая анемия развивается в результате нарушений в строении стволовых клеток, а гипопластическая анемия манифестирует на фоне аутоиммунных патологий.
При апластической анемии костный мозг поражается очень сильно, в результате чего он не в состоянии продуцировать никакие клетки. Гипопластическая анемия характеризуется не столь интенсивным угнетением функции кроветворения.
Различается механизм развития апластической и гипопластической анемии.
Если лечение будет подобранно верно, то гипопластическую анемию можно ввести в стадию ремиссии, которая продлится довольно долго. В то время как апластическая анемия очень сложно поддается лечению.
Прогноз на выживаемость более благоприятный именно при гипопластической анемии.
Некоторое время назад гипопластическую и апластическую анемию считали одним и тем же патологическим процессом, просто характеризовали они разные стадии его развития. Хотя до настоящего времени в ученых кругах по этому поводу имеются разногласия. В любом случае, в статье оба этих термина будут характеризовать одно и то же нарушение.
Терапия апластической анемии — это сложная задача, разрешить которую даже самым лучшим врачам не всегда под силу. О возможных направлениях в лечении будет сказано далее.
Приобретенная АА
Приобретенная апластическая анемия – такое состояние кроветворного органа, которое взялось как бы ниоткуда: семейный анамнез ничего плохого не предполагал, среди близких (да и дальних тоже) родственников больных нет, каких-то врожденных дефектов и аномалий у пациента не отмечается. Но в главном органе кроветворной системы производство клеток всех линий, циркулирующих в кровеносном русле и обеспечивающих нормальную жизнедеятельность организма, почему-то приостановилось. Возникшая в процессе жизни апластическая анемия, может быть представлена 4 видами:

- Идиопатическая апластическая анемия (причинные факторы, пусть при самом детальном обследовании, обозначить не представляется возможным) – составляет более 50% всех АА (по данным разных источников – от 50 до 80%);
- Вирусная АА (парвовирус В19, вирус Эпштейн-Барра, гепатитов);
- Аутоиммунная АА – болезнь обусловлена влиянием на кроветворные клетки аутоагрессивных (аутологичных) антител (аутоантитела – АТ, способные реагировать на собственные антигены);
- Транзиторная (временная) гипопластическая анемия – чаще всего отмечается у детей, дифференцируется с врожденной ГА и среди других костномозговых аплазий (у детей) занимает лидирующее положение, причина – временное (транзиторное) угнетение кроветворения в костном мозге, но на выздоровление при адекватном лечении можно рассчитывать через 1-2 месяца.
Для приобретенных АА также обозначены три формы течения с характерными для каждой из них четкими клинико-гематологическими особенностями:
- Сверхтяжелая форма (как правило, это острая апластическая анемия, которая развивается стремительно и дает практически 100% летальность);
- Тяжелая;
- Легкая форма, если можно так назвать, скорее, нетяжелая, что несколько меняет смысл, подразумевая удовлетворительное состояние кроветворения и самочувствие пациента.
Приобретенные аномалии стволовых клеток, дающих жизнь всему сообществу форменных элементов, могут возникать по разным причинам, основные из которых будет нелишним рассмотреть.
Классификация и стадии развития анемии
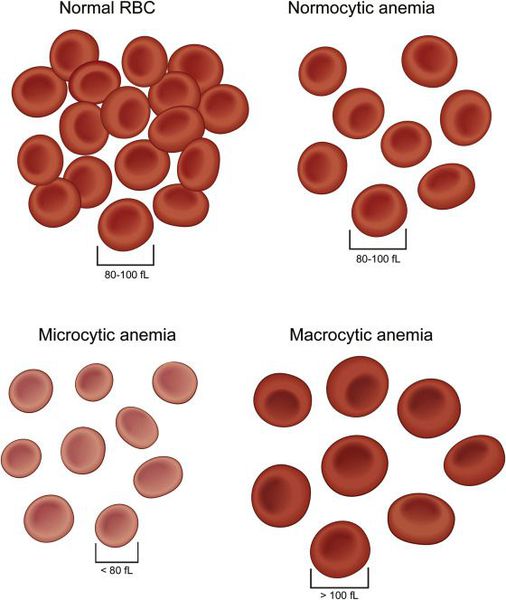
I. Классификация анемий по морфологии (размеру) эритроцитов
- Макроцитарная — тип анемии, при которой образуются эритроциты крупных размеров (макроциты):
- дефицит витамина В12 и фолиевой кислоты;
- эритролейкоз — это редкая форма острого миелоидного лейкоза (рака кроветворной системы), характеризующаяся наличием в крови большого количества ядерных эритроцитов;
- миелодисплазия — врождённое заболевание, характеризующееся патологическими изменениями в позвоночном столбе и спинном мозге и нарушениями миелоидного кроветворения (образования эритроцитов, гранулоцитов, тромбоцитов и моноцитов). Как правило, доброкачественные опухоли при миелодисплазии представлены кистами, реже встречаются другие формы новообразований.
- Анемия микроцитарная — разновидность анемий, которые характеризуются уменьшением размеров эритроцитов. К этому типу относятся:
- талассемия (анемия Кули) — заболевание, при котором нарушается синтез жизненно важного белка гемоглобина, входящего в состав эритроцитов.
- микросфероцитоз — это гемолитическая анемия, обусловленная генетическим дефектом мембран эритроцитов и характеризующаяся постоянным гемолизом — разрушением эритроцитов с выделением в окружающую среду гемоглобина;
- железодефицитная анемия.
- Нормоцитарная анемия — это тип анемии, при котором эритроциты имеют нормальный размер.
- гипопластическая — патология, характеризующаяся угнетением кроветворной функции костного мозга;
- гемолитические анемии — патология эритроцитов, в основе которой ускоренное разрушение красных кровяных телец;
- анемии вследствие хронических заболеваний;
- анемия при меилодиспластическом синдроме — заболевание системы крови, при которых нарушается нормальное кроветворение вследствие диспластических изменений костного мозга.
II. Классификация по цветовому показателю (ЦП)
- Гипохромная анемия (ЦП менее 0,8): железодефицитная анемия, железоперераспределительная анемия, талассемия и др.
- Нормохромная анемия (ЦП от 0.86 до 1.06 ): апластическая анемия, анемия при меилодиспластическом синдроме и др.
- Гиперхромная (ЦП выше 1,05): В12-дефицитная анемия, дефицит фолиевой кислоты и др.

III. Классификация анемий патогенетическая
Анемии вследствие кровопотери:
- Постгеморрагическая анемия острая.
- Постгеморрагическая анемия хроническая.
Анемии, вызванные нарушением образования гемоглобина и эритроцитов:
- Железодефицитная анемия.
- Анемия вследствие неправильного перераспределения железа.
- Железонасыщенная анемия из-за нарушения синтеза гема.
- Мегалобластные анемии при нарушении синтеза ДНК.
- В12-дефицит и дефицит фолиевой кислоты.
- Мегалобластные анемии при дефиците ферментов, принимающих участие в синтезе пуриновых оснований (аденина, гуанина), которые участвуют в построении нуклеотидов, нуклеиновых кислот и др. биологически активных соединений, и пиримидиновых оснований (урацила, цитозина, тимина), входящих в состав нуклеиновых кислот, нуклеозидов, нуклеотидов.
- В12 (фолиево)-ахрестическая анемия. Возникает вследствие того, что костный мозг не в состоянии использовать имеющиеся в организме антианемические субстанции (витамин B12, фолиевую кислоту).
- Анемии гипопролиферативные.
- Анемии вследствие недостаточности костного мозга.
- Апластическая анемия — патология кроветворной системы, которая подавляет кроветворную функцию костного мозга и проявляется низким образованием эритроцитов, лейкоцитов и тромбоцитов или только одних эритроцитов.
- Рефрактивная анемия при миелодиспластическом синдроме.
- Анемии метапластические
- Анемия вследствие гемобластозов (новообразований, развивающихся в кроветворной и лимфатической системе).
- Анемия вследствие метастазирования рака в костный мозг.
- Анемии из-за нарушения эритропоэза.
Анемии при усиленном кроверазрушении.
- Наследственные.
- При нарушении строения мембраны эритроцитов (анемия Минковского — Шоффара микросфероцитарная, овалоцитоз, акантоцитоз).
- При дефиците энзимов в эритроцитах.
- При нарушении образования гемоглобина (талассемия, серповидноклеточная анемия, гемоглобинозы).
- Приобретённые.
- Аутоиммунные.
- Периодическая ночная гемоглобинурия (попадание гемоглобина в мочу в результате повреждения сосудов). Причиной пароксизмальной ночной гемоглобинурии является соматическая мутация в стволовых клетках костного мозга, которая приводит к нарушению регулирования системы комплемента (части иммунной системы, которая осуществляет защиту от бактерий и других возбудителей болезней), разрушению эритроцитов, тромбозам вен и артерий, недостаточности костного мозга. Мутация находится в Х-сцепленном гене фосфатидилинозитолгликана класса А (PIG-A).
- Лекарственные.
- После травм и вследствие микроангиопатий.
- При отравлении гемолитическими ядами и токсинами бактерий.
IV. Анемии по степеням тяжести EORTC (Европейское общество диагностики и лечения рака)
Степень тяжести анемии и количество гемоглобина:
- 0 степень > 120 г/л;
- 1 степень — 120-100 г/л;
- 2 степень — 100-80 г/л;
- 3 степень — 80-65 г/л;
- 4 степень — менее 65 г/л [3] .
Прогноз и профилактика
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
2. Комплексная программа диагностики апластической анемии с определением прогностически значимых патогенетических особенностей заболевания. Методические рекомендации. — 2015.
4. Апластическая анемия: современные представления о патогенезе и терапии/ Айсариева Б. К., Раймжанов А. Р., Айтбаев К.// Молодой ученый. — 2011 — №9.
