
Аномальный дренаж легочных вен: что это, как проявляется, принципы лечения

При нормальном строении сердца в левое предсердие впадают легочные вены, и именно по ним насыщенная кислородом кровь поступает в левый желудочек, а затем – в аорту. Далее она разносится артериями по большому кругу кровообращения.
Под воздействием ряда внешних негативных факторов во внутриутробном периоде могут создаваться условия для формирования такого врожденного порока развития сердца как аномальный дренаж легочных вен (АДЛВ), при котором эти сосуды впадают не в левое, а в правое предсердие, полые вены или венечный синус. Такое ненормальное расположение сосудов может быть частичным или тотальным, т. е. с правым предсердием может сообщаться часть отдельных легочных вен или все устья этих сосудов. Именно от этих факторов во многом зависит состояние больного.
По данным статистики, АДЛВ выявляется у 1,5-3% пациентов с врожденными пороками развития сердца. Чаще такая патология обнаруживается среди мужчин.
Нередко АДЛВ сочетается с такими аномалиями развития сердца как открытое овальное окно и дефект межпредсердной перегородки. А у 20% больных ему сопутствуют другие дефекты: общий артериальный ствол, тетрада Фалло, декстрокардия, дефект межжелудочковой перегородки, недоразвитие левых камер сердца и др. Кроме этого, у пациентов с этим диагнозом нередко выявляются внекардиальные аномалии развития: подковообразная почка, поликистоз почек, гидронефроз, пупочные грыжи, дивертикулы кишечника и пороки развития опорно-двигательного аппарата или эндокринной системы.
В этой статье мы ознакомим вас с предположительными причинами, разновидностями, проявлениями, способами выявления и лечения аномального дренажа легочных вен. Полученная информация поможет вам понять суть такого врожденного порока сердца, и вы сможете задать интересующие вас вопросы лечащему врачу.
Немного истории
Впервые этот редкий врожденный порок был описан Вилсоном еще в 1798 году, но его варианты более детально были рассмотрены только после накопления достаточного кардиохирургического опыта в 50-60 годах XX века. Первая удачная операция по коррекции этой патологии была выполнена Миллером в 1951 году. Впоследствии кардиохирургические методики совершенствовались, и в 1956 году была проведена радикальная коррекция АДЛВ при помощи поверхностной гипотермии. В этом же году подобное вмешательство было выполнено с использованием искусственного кровообращения.
На территории СССР впервые успешная операция по устранению такого порока сердца была проведена Николаем Михайловичем Амосовым в 1978 году, а о выполнении серии удачных коррекций у детей раннего возраста в 1984 году сообщил один из ведущих российских кардиохирургов Георгий Эдуардович Фальковский.
Причины
Вероятными причинами развития АДЛВ могут становиться те же внешние факторы, которые провоцируют и другие врожденные аномалии строения сердца и сосудов:
- наследственность (мутации хромосом);
- прием некоторых тератогенных лекарств;
- воздействие токсических веществ на организм во время беременности;
- вредные привычки будущей матери;
- перенесенные беременной инфекционные заболевания;
- эндокринные нарушения;
- токсикоз;
- неблагоприятная экология.
Разобщенность легочных вен с левым предсердием может вызываться следующими факторами:
- отсутствие их соединения с левым предсердием – формируется из-за того, что под влиянием вышеописанных внешних причин левопредсердный вырост не может связаться с венозными сплетениями будущего легкого;
- ранняя атрезия легочной вены – происходит при первоначальном соединении легочного сосудистого ложа и общей легочной вены, просвет которых впоследствии облитерируется, и кровь из легких начинает поступать через иные коллатеральные пути.
Разновидности
АДЛВ бывает двух типов:
- Тотальный (или полный). При таком пороке кровообращение между большим и малым кругом полностью прекращается, так как сообщение между легочными венами и левым предсердием отсутствует. Эта форма порока несовместима с жизнью, однако у ребенка могут присутствовать такие сопутствующие аномалии развития сердца как дефекты межпредсердной или межжелудочковой перегородки, немного компенсирующие подобное существенное нарушение гемодинамики. В таких случаях малыш может некоторое время жить. Однако в большинстве случаев без своевременной кардиохирургической коррекции тотального АДЛВ дети погибают до первого года жизни.
- Частичный. При такой аномалии одна из ветвей легочных вен сообщается с левым предсердием, и состояние гемодинамики у больного зависит от объема сброса крови.
В зависимости от уровня впадения легочных вен в левое предсердие выделяют четыре анатомических варианта АДЛВ:
- надсердечный (или супракардиальный) – наблюдается почти у 55% новорожденных и сопровождается впадением легочных вен в систему верхней полой вены;
- сердечный (или интракардиальный) – выявляется у 30% больных и сопровождается впадением легочных вен в правое предсердие или венечный синус;
- подсердечный (или субкардиальный, инфракардиальный) – наблюдается у 12% детей и сопровождается впадением легочных вен в нижнюю полую или воротную вену (иногда в лимфатический проток);
- смешанный – выявляется у 3% новорожденных и может сопровождаться различными вышеописанными вариациями впадения легочных вен.
Как нарушается гемодинамика
Во время внутриутробного развития этот порок сердца никак себя не проявляет, так как внутрисердечное кровообращение у плода сопровождается сообщением левого и правого предсердия через открытое овальное окно. АДЛВ начинает давать о себе знать после рождения ребенка, и выраженность гемодинамических нарушений будет определяться типом и вариантом данной аномалии. Кроме этого, на выраженность симптомов порока может влиять наличие сопутствующих дефектов развития сердца и сосудов.
При тотальном АДЛВ поступающая в правое предсердие обогащенная кислородом кровь смешивается с венозной кровью. Далее некоторая ее часть попадает в правый желудочек, а другая поступает в левое предсердие через существующий дефект межпредсердной перегородки или открытое овальное окно. В таких случаях тотальный АДЛВ совместим с жизнью, так как сообщение между большим и малым кругом кровообращения не утрачивается. Подобные гемодинамические нарушения приводят к перегрузке правых камер сердца, повышению давления в легочных сосудах и понижению содержания кислорода в крови, которое приводит к кислородному голоданию органов и тканей.
При частичном АДЛВ нарушения гемодинамики происходят так же как и при межпредсердных дефектах. Тяжесть состояния больного при таком типе аномалии определяется объемом патологического артерио-венозного сброса.
Симптомы
Признаки АДЛВ дают знать о себе сразу же после рождения ребенка. При тотальном пороке, который не сопровождается присутствием дефектов межпредсердных коммуникаций, кровообращение между малым и большим кругом становится полностью невозможным, и новорожденный быстро погибает. Спасти жизнь ребенка в таких случаях может только экстренное выполнение такой кардиохирургической операции по методу Рашкинда как баллонная эндоваскулярная атриосептостомия.
В остальных случаях выраженность клинических проявления АДЛВ обуславливается его анатомическим вариантом, размером дефектов межпредсердной перегородки и характером гемодинамических нарушений. Обычно родители детей с таким врожденным пороком замечают следующие проявления этой патологии:
- быстрая утомляемость;
- появление одышки после физической активности (кормления, плача и пр.);
- боли в области сердца (ребенок плохо спит, беспокойный, громко плачет и вытягивает ножки);
- бледность кожи;
- легкий цианоз;
- кашель;
- тошнота и рвота;
- медленная прибавка веса;
- частые ОРВИ и пневмонии.
При прощупывании пульса врач может выявить его учащенность и аритмичность. При осмотре определяется деформация грудной клетки и усиленный толчок сердца.
Легкий цианоз, возникающий на первых неделях жизни, может со временем исчезать или становится менее выраженным. Как правило, синюшность более выражена при физической нагрузке.
При выслушивании тонов сердца специфические признаки данного порока не выявляются. Могут выслушиваться:
- громкий I тон над сердцем;
- расщепление II тона с усилением легочного компонента;
- выслушиваемый III тон над верхушкой сердца (у многих больных);
- мягкий систолический шум над легочной артерией с вариабельной продолжительностью и интенсивностью.
На ЭКГ определяется перегрузка правых отделов сердца – высокий вольтаж зубца Р в правых отведениях и отклонения электрической оси вправо в стандартных отведениях. На перегрузку правого предсердия указывает высокий Р зубец в правых грудных и стандартном отведениях. Нередко присутствуют признаки неполной блокады правой ножки пучка Гиса.
При наличии большого дефекта в межпредсердной перегородке ребенок может развиваться нормально и тогда в более старшем возрасте возникают жалобы на значительное снижение толерантности к физическим нагрузкам, одышку, бледность и плохое общее самочувствие. Позднее у таких детей возникают признаки правожелудочковой недостаточности.
Диагностика
Впервые АДЛВ может выявляться у плода при УЗ-обследовании в третьем триместре беременности.
Для уточнения всех данных о таком врожденном пороке сердца назначаются следующие инструментальные методики исследования:
- рентгенография;
- ЭКГ;
- Эхо-КГ (взрослым и детям старшего возраста назначается чреспищеводное Эхо-КГ);
- МРТ;
- зондирование камер сердца и ангиокардиография.
Лечение
Единственным способом устранения АДЛВ является его кардиохирургическая коррекция. До операции ребенку рекомендуется ограничение физической активности и назначаются лекарственные средства для профилактики острой сердечной недостаточности (мочегонные, сердечные гликозиды). Родители ребенка должны знать о том, что даже плач или температурный дискомфорт способны существенно ухудшать самочувствие при таком пороке сердца. Если ребенок уже взрослый, то они должны постоянно следить за его досугом – он не должен бегать, поднимать тяжести и переутомляться.
Методы хирургической коррекции
Способ выполнения кардиохирургической коррекции при АДЛВ определяется типом и вариантом порока.
При тотальном дренаже находящемуся в критическом состоянии ребенку до 3 месяцев может выполняться паллиативная операция, заключающаяся в увеличении межпредсердного сообщения при помощи проведения баллонной атриосептомии по методике Рашкинда. Такая коррекция способствует поступлению крови в левое предсердие и восстановлению кровообращения в большом круге.
Для радикального устранения АДЛВ проводятся вмешательства направленные на создание широкого анастомоза между левым предсердием и легочными венами, прекращение патологического дренажа легочных вен с другими венозными сосудами и устранение дефекта межпредсердной перегородки. Такие вмешательства предпочтительней выполнять в раннем возрасте. Методика радикальной коррекции выбирается в зависимости от анатомического варианта АДЛВ.
Корректирующие вмешательства являются достаточно эффективными, однако, несмотря на развитие современной кардиохирургии, процент летальных исходов, наступающих во время операции или в послеоперационном периоде, остается высоким. Результат радикальной коррекции во многом зависит от мастерства кардиохирурга, технического оснащения, типа и варианта порока. Кроме этого, наиболее высокий риск наступления смерти наблюдается среди новорожденных и детей раннего возраста, страдающих от выраженной легочной гипертензии. Чаще всего такое проявление порока наблюдается среди больных с субкардиальным вариантом аномалии.
Отдаленные результаты среди выживших после радикальной коррекции АДЛВ детей вполне удовлетворительные. Только у некоторых пациентов возможно развитие слабости синусового узла и легочной гипертензии, плохо поддающихся медикаментозной терапии.
Прогноз
Удачно выполненная радикальная кардиохирургическая коррекция АДЛВ существенно улучшает прогнозы исхода этого порока сердца. Однако риск летального исхода во время или после операции пока остается высоким.
При тотальной форме АДЛВ и отсутствии экстренной кардиохирургической коррекции в возрасте до года погибает около 80% детей. Если аномальный дренаж легочных вен является частичным, то больные могут доживать до 20-30 лет. При отсутствии хирургического лечения такие пациенты умирают от сердечной недостаточности или легочных инфекций.
Аномальный дренаж легочных вен относится к редким врожденным порокам сердца и всегда нуждается в проведении кардиохирургической коррекции. В некоторых случаях состояние новорожденного ребенка из-за существенных гемодинамических нарушений становится критическим, и такие операции выполняются в экстренном порядке. После проведения удачной радикальной кардиохирургической коррекции состояние больного значительно улучшается, и прогноз исхода заболевания становятся благоприятным.
Аномальный дренаж легочных вен
Аномальный дренаж легочных вен – врожденная патология сердца, морфологическую основу которой составляет аномальное впадение легочных вен в правое предсердие либо входящие в него полые вены. Аномальный дренаж легочных вен проявляется утомляемостью, отставанием в физическом развитии, болями в сердце, одышкой, повторными пневмониями. Для диагностики аномального дренажа легочных вен проводится рентгенография, ЭКГ, УЗИ сердца, зондирование сердца, ангиопульмонография, атрио- и вентрикулография, МРТ. Варианты хирургической коррекции аномального дренажа легочных вен различаются в зависимости от типа порока.
- Причины аномального дренажа легочных вен
- Классификация аномального дренажа легочных вен
- Особенности гемодинамики при аномальном дренаже легочных вен
- Симптомы аномального дренажа легочных вен
- Диагностика аномального дренажа легочных вен
- Лечение аномального дренажа легочных вен
- Прогноз аномального дренажа легочных вен
- Цены на лечение
Общие сведения
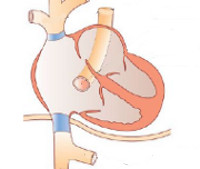
Аномальный дренаж легочных вен – врожденный порок сердца, при котором имеет место впадение устьев всех или отдельных легочных вен в правое предсердие, венечный синус или полые вены. Аномальный дренаж легочных вен составляет 1,5-3% всех ВПС в кардиологии с преобладанием у лиц мужского пола.
Чаще всего аномальный дренаж легочных вен сочетается с дефектом межпредсердной перегородки (ДМПП) и открытым овальным окном; в 20% случаев — с общим артериальным стволом, ДМЖП, транспозицией магистральных сосудов, тетрадой Фалло, стенозом легочной артерии, гипоплазией левых отделов сердца, единственным желудочком сердца, декстрокардией. Из экстракардиальной патологии у пациентов с аномальным дренажом легочных вен встречаются дивертикулы кишечника, пупочные грыжи, поликистоз почек, гидронефроз, подковообразная почка, а также различные пороки развития костной и эндокринной систем.

Причины аномального дренажа легочных вен
Общие причины, формирующие аномальный дренаж легочных вен, не отличаются от таковых при других ВПС.
Непосредственное разобщение легочных вен с левым предсердием может быть связано с двумя факторами: отсутствием их соединения или ранней атрезией общей легочной вены. В первом случае под воздействием неблагоприятных условий левопредсердный вырост не связывается должным образом с венозными сплетениями зачатка легкого, что приводит к формированию аномального венозного дренажа. При ранней атрезии имеет место первоначальное соединение общей легочной вены и легочного сосудистого ложа, однако в дальнейшем происходит облитерация их просвета, поэтому венозный легочный возврат начинает осуществляться через другие доступные коллатеральные пути.
Классификация аномального дренажа легочных вен
При впадении устьев всех легочных вен в венозную систему большого круга кровообращения или правое предсердие говорят о полном (тотальном) аномальном дренаже легочных вен. Если в правое предсердие или большой круг дренируется одна или несколько легочных вен, такая форма порока называется частичной. Чаще всего (в 97% случаев) аномально дренируются вены, отходящие от правого легкого.
На основании уровня впадения легочных вен аномальный дренаж классифицируется на 4 анатомических типа (варианта).
- I вариант — супракардиальный (надсердечный). Легочные вены общим коллектором или по-отдельности дренируются в верхнюю полую вену или ее ветви (непарную вену, левую безымянную либо добавочную верхнюю полую вену).
- II вариант – интракардиальный (сердечный). Аномальный дренаж легочных вен происходит в правое предсердие или венечный синус.
- III вариант – субкардиальный, инфракардиальный (подсердечный). Легочные вены впадают в нижнюю полую или воротную вену (редко – в лимфатический проток).
- IV вариант – смешанный. Аномальный дренаж легочных вен в венозную систему осуществляется на различных уровнях в разных сочетаниях.
Особенности гемодинамики при аномальном дренаже легочных вен
В антенатальном периоде порок обычно не имеет гемодинамических проявлений, поскольку внутрисердечное кровообращение у плода подразумевает поступление крови из правого предсердия в левое (через открытое овальное окно) и в боталлов проток. После рождения выраженность гемодинамических нарушений определяют форма (полная или частичная), вариант аномального дренажа легочных вен, а также сочетание порока с другими дефектами сердца.
С точки зрения гемодинамики, тотальный аномальный дренаж легочных вен характеризуется тем, что вся оксигенированная кровь из легких попадает в правое предсердие, где смешивается с венозной кровью. В дальнейшем одна часть крови поступает в правый желудочек, другая – через межпредсердную коммуникацию в левое предсердие и большой круг кровообращения. В этом случае аномальный дренаж легочных вен совместим с жизнью только при условии наличия сообщения между двумя кругами кровообращения, роль которого выполняют ДМПП или открытое овальное окно. Нарушение гемодинамики при тотальном аномальном дренаже легочных вен сопровождаются гиперкинетической перегрузкой правых отделов сердца, легочной гипертензией и гипоксемией.
При частичной форме аномального дренажа легочных вен гемодинамические нарушения аналогичны таковым при межпредсердных дефектах. Определяющая роль среди них принадлежит патологическому артерио-венозному сбросу крови, приводящему к увеличению объема крови в легочном круге кровообращения.
Симптомы аномального дренажа легочных вен
В основе клинических проявлений аномального дренажа легочных вен лежат анатомо-гемодинамические особенности: уровень общелегочного сопротивления, степень обструкции венозного возврата, размеры межпредсердной коммуникации, функционирование миокарда правого желудочка. При отсутствии дефекта в межпредсердной перегородке или его чрезвычайно маленьком размере порок несовместим с жизнью – в этом случае спасти ребенка позволяет только экстренная эндоваскулярная баллонная атриосептостомия по Рашкинду.
У детей с аномальным дренажом легочных вен отмечаются частые повторные пневмонии и ОРВИ, малая прибавка в массе, одышка, легкий цианоз, кашель, быстрая утомляемость, отставание в физическом развитии, боли в сердце, тахикардия. При выраженной легочной гипертензии уже в раннем детстве развиваются выраженный цианоз, сердечный горб и сердечная недостаточность.
Диагностика аномального дренажа легочных вен
Аускультативная картина аномального дренажа легочных вен напоминает ДМПП и характеризуется негрубым систолическим шумом в проекции легочной артерии, расщеплением II тона. Данные ЭКГ свидетельствуют о перегрузке правых отделов, неполной блокаде правой ножки пучка Гиса; ЭОС отклонена вправо. Фонокардиография соответствует всем признакам ДМПП.
При анализе результатов рентгенографии грудной клетки обращает внимание расширение границ сердца вправо, выбухание дуги легочной артерии, усиление легочного рисунка. Достоверным признаком аномального дренажа легочных вен в нижнюю полую вену является симптом «турецкой сабли».
По данным ЭхоКГ устья легочных вен в левом предсердии не обнаруживаются; выявляется дилатация правого желудочка, уменьшенные размеры левых отделов сердца и другие косвенные признаки аномального дренажа легочных вен. Старшим детям и взрослым проводится чреспищеводная ЭхоКГ.
При зондировании полостей сердца катетер из правого предсердия или полой вены проводится в легочную вену. На данном этапе диагностики возможно установить локализацию впадения и количество аномально дренирующихся легочных вен. Правая атриография, вентрикулография, ангиопульмонография, флебография ВПВ позволяют проследить движение контраста через малый круг кровообращения в правое предсердие или полые вены.
У пациентов с аномальным дренажом легочных вен в дифференциально-диагностическом плане необходимо исключить атрезию митрального или аортального клапана, митральный стеноз, изолированный ДМПП, трехпредсердное сердце, стеноз легочных вен, транспозицию магистральных сосудов, лимфангиоэктазию.
Лечение аномального дренажа легочных вен
Способ хирургической коррекции частичного аномального дренажа легочных вен определяется видом порока: при этом учитывается уровень дренирования, размеры и расположение ДМПП. В зависимости от названных критериев используются многочисленные варианты реплантации устьев легочных вен или их общих коллекторов в левое предсердие. Для устранения межпредсердного сообщения производится ушивание или пластика ДМПП. Детям в возрасте до 3 месяцев, находящимся в критическом состоянии, проводится паллиативная операция закрытой атриосептотомии, направленная на увеличение межпредсердного сообщения.
К общим принципам радикальной коррекции тотального аномального дренажа легочных вен относятся: создание анастомоза между легочными венами и левым предсердием, закрытие ДМПП, перевязка патологического сообщения легочных вен с венозными сосудами. После операции может развиваться синдром слабости синусового узла, увеличение легочной гипертензии, связанное с неадекватным обеспечением путей оттока из легочных вен.
Прогноз аномального дренажа легочных вен
Естественное течение тотального аномального дренажа легочных вен неблагоприятно: 80% детей погибает в первый год жизни. Пациенты с частичным дренажом легочных вен могут дожить до 20-30 лет. Гибель больных связана с тяжелой сердечной недостаточностью или легочными инфекциями.
Результаты хирургической коррекции аномального дренажа легочных вен удовлетворительные, однако среди новорожденных интра- и послеоперационная летальность остается высокой.
Аномальный дренаж легочных вен у плода, новорожденного ребенка, взрослого: лечение

Врожденные пороки сердца (сокращенно ВПС) – это структурные аномалии в строении сердца или главных сосудов, отходящих от него, которые присутствуют у ребенка с момента рождения.
Примерно 8-10 из каждых 1000 младенцев рождаются с одним из видов ВПС.
Причины ВПС
В большинстве случаев выявить причину ВПС не удается. Тем не менее, риск появления этих проблем могут следующие факторы:
- Синдром Дауна у плода – генетическое заболевание, которое нарушает нормальное физическое развитие плода и вызывает слабоумие.
- Другие генетические заболевания у плода – синдромы Тернера и Нунана
- Перенесенные мамой во время беременности инфекционные заболевания – например, краснуха и грипп.
- Наличие у мамы плохо контролируемого сахарного диабета.
- Злоупотребление алкоголем во время беременности.
- Наличие у мамы фенилкетонурии (если она не соблюдает рекомендации касательно лечебного питания).
- Прием мамой во время беременности некоторых медикаментов (бензодиазепины, ибупрофен, препараты лития, изотретиноин).
- Воздействие на организм мамы органических растворителей.
Виды ВПС
Существует более 30 видов ВПС, которые разделяют на две группы:
- 1. Цианотические ВПС – характеризуются возникновением цианоза (посинение кожных покровов) вследствие попадания бедной кислородом венозной крови в большой круг кровообращения (сброс справа налево).
- 2. Нецианотические ВПС – характеризуются попаданием богатой кислородом крови из левой половины сердца в правую, а затем – в легкие.
К цианотическим ВПС принадлежат:
- Тетрада Фалло – самая частая причина цианотических ВПС, которая является комбинацией 4 различных пороков. Она включает отверстие (дефект) в межжелудочковой перегородки (сокращенно МЖП), суженный клапан легочной артерии, утолщение мышц (гипертрофия) правого желудочка (сокращенно ПЖ) и неправильное отхождение аорты (она соединена и с левым, и с правым желудочками).
- Транспозиция магистральных сосудов – это ВПС, при котором аорта отходит от ПЖ, а легочной ствол – от левого желудочка (сокращенно ЛЖ). При таком расположении аорты к органам попадает бедная на кислород кровь.
- Атрезия ТК – это нарушение развития клапана, разделяющего правое предсердие (сокращенно ПП) и ПЖ.
- Аномальный дренаж легочных вен – это врожденный порок, при котором все или часть легочных вен, в норме несущих обогащенную кислородом кровь в ЛП, соединяются с правой половиной сердца.
- Общий артериальный ствол – это редкая форма ВПС, при которой во время внутриутробного развития не происходит разделение одного артериального ствола на две артерии – легочную и аорту. При этом пороке из сердца выходит один сосуд, который несет смешанную кровь.
- Гипоплазия левых отделов сердца – порок, при котором левая половина сердца развивается недостаточно и не может обеспечить адекватное кровоснабжение всех органов.
К ацианотическим ВПС принадлежат:
- Дефект МЖП – это наличие отверстия в стенке, разделяющей ПЖ и ЛЖ. Этот порок составляет около 30% от всех ВПС.
- Дефект межпредсердной перегородки (сокращенно МПП) – наличие отверстия в перегородке, отделяющей ПП от ЛП. Подробнее про это заболевание читайте в статье http://okardio.com/bolezni-serdca/dmpp-433.html.
- Открытый артериальный проток – это незарастание артериального протока, соединяющего аорту и ЛС во время внутриутробного развития плода, после рождения.
- Атриовентрикулярный септальный дефект – это ВПС, поражающий клапаны между верхними и нижними камерами сердца, а также перегородки между ними.
- Стеноз легочной артерии – сужение крупного сосуда, несущего кровь от ПЖ в легкие для обогащения кровью.
- Коарктация аорты – врожденное сужение аорты, выходящей из ЛЖ и несущей кровь по всему организму.
Симптомы ВПС
Так как ВПС нарушают способность сердца перекачивать кровь и доставлять кислород по всему организму, они часто вызывают у маленьких детей следующие симптомы:
- Синий оттенок (цианоз) губ, языка и ногтевых лож.
- Учащенное дыхание или одышка.
- Плохой аппетит или трудности с кормлением, во время которого у ребенка может возникать или усиливаться цианоз.
- Снижение веса или недостаточное его увеличение.
- Задержка в умственном и физическом развитии.
- Потливость, особенно во время кормления.
У старших детей наблюдается повышенная утомляемость, общая слабость, одышка во время физической нагрузки, синкопальные состояния (обмороки), боль в грудной клетке, которые могут очень сильно ухудшать качество их жизни и мешать любой деятельности.
При тяжелых пороках симптомы болезни появляются почти сразу после рождения ребенка. Тем не менее, клиническая картина иногда развивается лишь в подростковом или взрослом возрасте.
Осложнения ВПС
Дети и взрослые с врожденными аномалиями в строении сердца имеют повышенный риск развития различных проблем со здоровьем.
Многие дети с ВПС страдают от задержки развития. Например, они могут позже начинать ходить или говорить, у них также могут наблюдаться пожизненные проблемы с физической координацией. Некоторые из этих детей также имеют трудности с обучением. Эти негативные последствия связаны с плохим поступлением кислорода в раннем периоде жизни, что влияет на развитие головного мозга.
У людей с ВПС также повышается опасность возникновения респираторных инфекционных заболеваний, таких как пневмония. Эти болезни проявляются кашлем, чиханием, учащенным дыханием и повышением температуры тела.
Кроме этого, при наличии пороков увеличивается вероятность развития эндокардита – инфекционного воспаления внутренней оболочки сердца и клапанов. Это очень опасное заболевание, которое при отсутствии правильного и своевременного лечения может привести к гибели пациента. Симптомы эндокардита включают повышение температуры тела, озноб, головные боли, одышку, усиленное потоотделение в ночное время, кашель, ухудшение аппетита, боль в мышцах и суставах.
Некоторые врожденные пороки при отсутствии своевременного лечения могут привести к легочной гипертензии – повышению давления внутри легочной артерии. Это осложнение может проявляться одышкой, усталостью, головокружениями, обмороками, болью в грудной клетке.
Дети и взрослые с ВПС также имеют повышенный риск развития различных нарушений сердечного ритма, включая предсердные и желудочковые аритмии.
Основным осложнением нелеченных пороков сердца является сердечная недостаточность, которая может развиваться как сразу после рождения ребенка (при тяжелых ВПС), так и намного позже. Ее симптомы включают одышку (сперва при физических нагрузках, а затем и в состоянии покоя), чрезмерную усталость и общую слабость, отеки на ногах, асцит.
Диагностика ВПС
Во многих случаях врожденные пороки сердца удается диагностировать во время беременности.
Заподозрить наличие ВПС можно во время обычного ультразвукового обследования плода в матке. Чтобы подтвердить или опровергнуть этот диагноз, проводится фетальная эхокардиография – специализированный ультразвуковой метод исследования сердца плода. Как правило, фетальную эхокардиографию проводят в термине 16-18 недель, после того, как врачи заподозрили наличие проблем при проведении обычного ультразвукового исследования. Также метод может применяться для выявления ВПС у плода, если у кого-то из близких родственников была эта проблема, или у матери есть другие факторы риска возникновения пороков (например, сахарный диабет, перенесенная во время беременности краснуха).
После родов всех детей осматривает врач-неонатолог. Этот осмотр обязательно включает аускультацию сердца, во время которой при наличии ВПС можно услышать патологические сердечные шумы. Уточнить диагноз можно с помощью эхокардиографии. Кроме этого, иногда проводят следующие обследования:
- Электрокардиография (ЭКГ) – безболезненный метод, записывающий электрическую активность сердца.
- Рентгенография органов грудной полости – безболезненное обследование, позволяющее получить изображение сердца и легких.
- Катетеризация сердца – инвазивный метод исследования, при котором в полость сердца заводится тонкий и гибкий катетер, через который выполняется контрастирование его камер.
Лечение ВПС
Лечение ВПС зависит от конкретного вида порока. Вопреки заблуждениям, далеко не всем детям с ВПС нужно хирургическое вмешательство. Иногда пороки закрываются со временем самостоятельно, иногда они настолько незначительны, что лечение не нужно.
Тем не менее, достаточно часто детям с ВПС нужно хирургическое восстановление нормальной анатомии сердца. Время проведения операции зависит от вида и тяжести порока. Некоторым пациентам со сложными ВПС может понадобиться несколько хирургических вмешательств.
Существует два основных метода восстановления анатомии сердца:
- Катетерные процедуры – это малоинвазивные операции, которые проводятся с помощью специальных катетеров, заведенных в полость сердца через сосуды. Катетерные процедуры чаще всего используют для устранения простых пороков, таких как дефект МПП или стеноз Кл.ЛА.
- Операции на открытом сердце – большие хирургические вмешательства, во время которых кардиохирурги через разрез в стенке грудной полости получают непосредственных доступ к сердцу. Этот метод позволяет восстановить нормальную анатомию сердца при сложных пороках.
Своевременное проведение хирургического вмешательства в большинстве случаев позволяет полностью вылечить ребенка, предоставляя ему возможность провести полноценную и долгую жизнь.
Прогноз при ВПС
Прогноз для детей с ВПС в течение последних десятилетий существенно улучшился. Точные показатели зависят от вида врожденного порока, времени установления диагноза и метода лечения. Примерно 97% детей с некритическими ВПС доживают до 1 года, а 95% – до 18 лет. Примерно 75% младенцев, родившихся с критическими ВПС, доживают до 1 года, а 69% – до 18 лет. Дети, которые перенесли хирургическое вмешательство для лечения ВПС, все еще имеют сниженную выживаемость, по сравнению со здоровыми детьми.
Врожденный измененный дренаж легочных вен: причины, способы коррекции

Аномальный дренаж легочных вен (АДЛВ) – разновидность неправильного формирования сердца, сопровождающаяся попаданием оксигенированной (богатой кислородом) крови после ее прохождения по сосудам легких снова в вены ребенка. Легочные вены (ЛВ), несущие артериальную кровь, соединяются не с полостью левого предсердия, а с крупными венами или правыми сердечными отделами. Такие изменения составляют 3% сердечных аномалий, чаще страдают мальчики.
Причины изменения дренажа легочных вен у новорожденных
Точные причины, по которым формируется АДЛВ, неизвестны. Предполагается, что он развивается, как и другие сердечные аномалии, при генетической предрасположенности, мутациях клеток плода и действии на него вредных факторов среды:
- прием препаратов с тератогенным эффектом;
- интоксикации матери, как в быту, так и на производстве, особенно на раннем сроке беременности;
- курение и употребление спиртных напитков будущей мамой;
- инфекции, перенесенные во время беременности;
- гормональные нарушения;
- токсикоз начала беременности;
- проживание в экологически неблагоприятном районе и так далее.

Действие этих факторов не в 100% случаев приведет к развитию порока сердца у ребенка. Для этого необходимы и другие, пока неизвестные науке предпосылки.
Непосредственно разобщение ЛВ и левого предсердного отдела развивается по одному из двух основных механизмов:
- во время внутриутробного периода вырост левого предсердия не объединяется с зачаточными ЛВ;
- формируется раннее закрытие, или атрезия, эмбриональных сосудистых путей, в частности, ЛВ; кровь из легких оттекает по другим венозным ветвям.
А здесь подробнее о легочной эмболии.
Классификация аномального дренажа
Существует 2 разновидности порока – тотальный и неполный. С учетом расположения устий ЛВ выделяют 4 анатомических подтипа патологии.
Тотальный
Кровь в сосуды большого круга не поступает, а постоянно сбрасывается в малый. Такая аномалия несовместима с жизнью. Однако новорожденный некоторое время может жить в том случае, если одновременно у него имеется другой порок сердца, обеспечивающий сообщение между камерами сердца справа и слева, например, дефект перегородки между предсердиями. Если не сделать операцию, младенец живет не более года.

Частичный
Часть вен, выходящих из легких, открывается в правое предсердие, а часть – в левое, поэтому некоторое количество артериальной крови попадает в аорту. Жизнеспособность ребенка до операции определяется объемом артериальной крови, распределенной между двумя сторонами сердца. Однако такой порок обязательно сопровождается повышенным давлением в сосудах легких, и хирургическое исправление дефекта необходимо выполнить как можно раньше.
Классификация по анатомическим типам
ЛВ могут заканчиваться в разных венозных отделах. Поэтому различают 4 анатомических типа этого порока:
- супракардиальный: самый частый (55% случаев) вариант, когда ЛВ открываются в верхнюю полую вену, а уже оттуда смешавшаяся кровь попадает в правое предсердие (ПП);
- интракардиальный: регистрируется у трети пациентов; ЛВ впадают в ПП;
- субкардиальный: наиболее редкий вариант, при котором ЛВ объединяются с нижней полой, воротной венами либо грудным лимфатическим протоком.

Особенности гемодинамики у детей с патологией
Плод получает кровь по пуповине, поэтому легкие у него не задействованы. Венозная кровь поступает в ПП, потом в правый желудочек (ПЖ), затем сквозь овальное окно – в левое предсердие (ЛП), левый желудочек (ЛЖ) и дальше в кровоток. До появления новорожденного на свет диагностировать АДЛВ можно в 3-ем триместре, когда постепенно начинается кровоснабжение легких.
После рождения младенца альвеолы и сосуды легких раскрываются, и в них начинается газообмен во время дыхания. При этом венозная кровь попадает в правые сердечные камеры и легочную артерию, а оттуда – в мелкие сосуды легких. Там она обогащается кислородом и по ЛВ проходит в ЛП, ЛЖ и выбрасывается в аорту.
При АДЛВ кровь из легких идет в правые камеры, затем опять в легочные артерии, затем в вены и далее по кругу. В артериях тела кровоток отсутствует, и родившийся ребенок нежизнеспособен.
Из-за постоянного нагнетания крови повышается давление в правых предсердии и желудочке, что ведет к гипертензии и в легочных сосудах. При длительном сохранении такой ситуации у ребенка развивается комплекс Эйзенменгера – тяжелейшее необратимое состояние, связанное с сердечной недостаточностью.
При частичном АДЛВ кровь из легких все же проникает в аорту. Концентрация кислорода в ней нормальная, но объем меньше, чем необходимо. Поэтому такие дети плохо переносят нагрузку. Также у них возникает легочная гипертензия и комплекс Эйзенменгера.

Симптомы нарушений
При полном АДЛВ и отсутствии других дефектов развития сердца после рождения организм ребенка не обеспечивается кислородом, и младенец быстро гибнет. В этой ситуации помочь может лишь один метод – экстренное введение через крупный сосуд раздуваемого катетера и перфорация перегородки между предсердиями. Такая операция создает временный путь оттока артериальной крови в сосуды тела.
При частичном АДЛВ или сопутствующих дефектах внутрисердечных перегородок симптомы проявляются довольно быстро:
- одышка при плаче, кормлении;
- бледный, синюшный оттенок кожи, особенно над верхней губой;
- замедление роста и развития;
- постоянные ОРЗ и пневмонии;
- кашель, рвота;
- беспокойное поведение младенца, беспричинный плач, плохой сон.
Если поток крови обратно в правое предсердие небольшой, симптомы болезни возникают у детей более старшего возраста:
- быстрая утомляемость;
 Синюшный оттенок кожи, особенно над верхней губой
Синюшный оттенок кожи, особенно над верхней губой - малоподвижность;
- бледность и синюшность кожи;
- низкий рост и вес;
- одышка при физической активности;
- тяжесть в правом подреберье;
- отеки на стопах, лодыжках, голенях.
Эхокардиография и другие методы диагностики
Заподозрить порок сердца врач может, обнаружив симптомы заболевания, а также сердечные шумы:
- усиление I-го тона на верхушке;
- расщепление II-го тона с акцентом на легочной артерии и систолический шум здесь же;
- III тон на верхушке.
На ЭКГ определяются симптомы увеличения ПП и ПЖ:
- высокий P-pulmonale с заостренной верхушкой во II стандартном отведении;
- высокоамплитудный P в отведении V1;
- блокада правой ножки пучка Гиса (чаще полная);
- признаки увеличения ПЖ (высокий R в V1, глубокий S в V4 – V6 и другие).

Дополнительную информацию дает рентгенография легких и МР-томография сердца.
Для уточнения тяжести легочной гипертензии и ее обратимости, то есть для ответа на вопрос, не поздно ли уже делать операцию, в кардиохирургических центрах проводится катетеризация камер сердца с определением в них давления.
Операция как шанс на спасение
Единственный способ спасти жизнь ребенка при этом пороке – хирургическое вмешательство. При подготовке к нему назначаются диуретики, Дигоксин и другие средства для предотвращения внезапной сердечной недостаточности. Резко ограничивается физическая нагрузка. Чем раньше будет сделана операция при таком заболевании, тем лучше прогноз для ребенка.
-
- Новорожденным и младенцам до 3 месяцев выполняется экстренная операция – создание искусственного дефекта перегородки между предсердиями.
- После подготовки малыша производится радикальное вмешательство: восстанавливается нормальная связь легочных вен и левого предсердия, устраняются ветви с неправильным анатомическим расположением, корригируются сопутствующие дефекты.
Операция наиболее опасна у детей младше 3-х месяцев и пациентов с развившейся легочной гипертензией. Поэтому важно не пропустить тот момент, когда ребенок уже готов к вмешательству, но у него еще не появились необратимые нарушения сердечно-легочного комплекса.
Смотрите на видео об операции при пороке АДЛВ:
Прогноз при дренаже легочных вен
Тотальный АДЛВ без радикального хирургического лечения в течение первого года приводит к летальному исходу у 80% детей. При частичном варианте патологии продолжительность жизни без лечения может достигать 30 лет.
Если радикальная операция выполнена вовремя и без осложнений, то ее прогноз благоприятный: ребенок полностью выздоравливает и в дальнейшем нормально развивается.
А здесь подробнее о легочном сердце.
АДЛВ – врожденный сердечный порок, который характеризуется попаданием артериальной крови в венозные сосуды и легочной гипертензией. Болезнь требует радикального хирургического лечения в возрасте пациентов от 3 месяцев до 1 года.

Лечение в виде операции может стать единственным шансом для больных с дефектом межпредсердечной перегородки. Он может быть врожденным пороком у новорожденного, проявиться у детей и взрослых, вторичным. Иногда происходит самостоятельное закрытие.

Опасная легочная гипертензия может быть первичная и вторичная, она имеет разные степени проявления, существует специальная классификация. Причины могут быть в патологиях сердца, врожденными. Симптомы — цианоз, сложности с дыханием. Диагностика многообразна. Более-менее позитивный прогноз при идиопатической легочной артерии.

Выполняется МРТ сердца по показателям. И даже детям делают обследование, показаниями для которого становятся пороки сердца, клапанов, коронарных сосудов. МРТ с контрастированием покажет способность миокарда накапливать жидкость, выявит опухоли.

Такая патология, как транспозиция магистральных сосудов, проявляется у новорожденных практически сразу. Причины развития ВПС (корригированной, полной) может быть в неправильном образе жизни матери. Операция становится шансом на нормальную, хоть и с ограничениями жизнь.

Если диагностирована легочная гипертензия, лечение необходимо начинать скорее, чтобы облегчить состояние больного. Препараты для вторичный или высокой гипертензии назначаются комплексно. Если методы не помогли, прогноз неблагоприятен.

С диагнозом жидкость в легких при сердечной недостаточности лечение пациенту необходимо предоставить как можно скорее. Без него можно умереть!

ВПВ или синдром верхней полой вены возникает по причини сдавления из-за внешних факторов. Симптомы проявляются расширение вен в верхней части туловища, синюшностью лица. Лечение заключается в снятии симптомокомплекса и терапии основного заболевания.

Закупорка легочной артерии — серьезная угроза для жизни. Врачи называют ее легочная эмболия. Какие причины и симптомы заболевания? Как тромболегочная эмболия, связанная с опухолями, выявляется? Как проводится лечение?

Проводится катетеризация сердца для подтверждения серьезных патологий. Может быть выполнено обследование правых отделов, полостей. Его также проводят при легочной гипертензии.
Тотальный аномальный дренаж легочных вен
АЧТВ — активированное частичное тромбопластиновое время
ВПВ — верхняя полая вена
ВПС – врожденный порок сердца
ДМПП – дефект межпредсердной перегородки
ЛА – легочная артерия
ЛП – левое предсердие
МПС – межпредсердное сообщение
МРТ – магнитно-резонансная томография
НПВ – нижняя полая вена
НРС – нарушения ритма сердца
ООО – открытое овальное окно
ПВ – поперечная вена
ПЖ – правый желудочек
ПП — правое предсердие
РЧА – радиочастотная абляция
СМ-ЭКГ – суточное мониторирование электрокардиограммы
ТАДЛВ – тотальный аномальный дренаж легочных вен
НПВП — нестероидные противовоспалительные средства
КТ — компьютерная томография
КТ-АГ — компьютерно-томографическая ангиография
МРТ — магнитно-резонансная томография
1. 2018 Клинические рекомендации «Тотальный аномальный дренаж легочных вен» (Ассоциация сердечно-сосудистых хирургов России)
Определение
Тотальный аномальный дренаж легочных вен (ТАДЛВ) – группа врожденных пороков сердца, при котором отсутствует прямая связь легочных вен с левым предсердием.
Морфологические критерии порока:
- Дилатация и гипертрофия правого желудочка и правого предсердия, дилатация легочной артерии;
- Левая половина сердца относительно неразвита, особенно левое предсердие: его объём уменьшается до 50% от нормы;
- При супракардиальной форме ТАДЛВ легочные вены с обеих сторон формируют общий коллектор, расположенный позади левого предсердия;
- При интракардиальной форме ТАДЛВ место соединения обычно находится в нижнезадней части правого предсердия (в случае дренажа легочных вен в коронарный синус аномальный венозный путь проходит внутри перикарда);
- При инфракардиальной форме ТАДЛВ дистальное место соединения расположено ниже диафрагмы;
- Аномальная вена соединяется с портальной веной в месте слияния селезёночной и верхней мезентериальной вен;
- Обструкция легочного венозного возврата встречается при соединении аномального ствола с венозным протоком, с одной из печеночных вен или непосредственно с НПВ.
Кроме того, каждая из анатомических форм тотального аномального дренажа легочных вен с различной частотой встречаемости может сопровождаться обструкцией легочного венозного возврата, что оказывает решающее влияние на состояние гемодинамики и клинические проявления порока.
- тетрада Фалло; тетрада Фалло с отсутствием клапана легочной артерии;
- единственный желудочек;
- корригированная и полная транспозиция магистральных сосудов;
- коарктация аорты, перерыв дуги аорты;
- атриовентрикулярный септальный дефект;
- синдромом гипоплазии левых отделов сердца;
- дефект межжелудочковой перегородки;
- общий артериальный ствол;
- двойное отхождение сосудов от правого желудочка;
- пороки желудочно-кишечного тракта;
- пороки мочеполовой системы;
- синдром турецкой сабли.
Терминология
Катетеризация полостей сердца и ангиокардиография – инвазионный метод диагностики и оценки центральной гемодинамики, предполагающий непосредственное измерение давления в полостях сердца, получение проб крови из них для оценки газового состава и их контрастирование.
Тотальный аномальный дренаж легочных вен, супракардиальная форма — общий коллектор легочных вен, расположенный позади левого предсердия, дренируется в верхнюю полую вену (ВПВ) через левую вертикальную и левую безымянную вены.
Тотальный аномальный дренаж легочных вен, интракардиальная форма — общий коллектор легочных вен дренируется в коронарный синус или они раздельно четырьмя устьями впадают в правое предсердие.
Тотальный аномальный дренаж легочных вен, инфракардиальная форма (субдиафрагмальный вариант) — общий коллектор легочных вен дренируется в воротную вену, венозный проток, печеночную вену или в нижнюю полую вену (НПВ). Общая легочная вена через вертикальную вену, которая прободает диафрагму в области пищеводного отверстия, соединяется с воротными венами и НПВ через венозный проток или печеночные синусоиды.
Тотальный аномальный дренаж легочных вен, смешанная форма – этот тип представляет собой комбинацию предшествующих вариантов.
«Крыша» коронарного синуса – это верхняя часть стенки коронарного синуса.
Критерии оценки качества медицинской помощи
Критерии качества
Уровень убедительности рекомендации
Уровень достоверности доказательств
Этап постановки диагноза
Этап консервативного и хирургического лечения
Выполнена операция анатомической коррекции тотального аномального дренажа легочных вен при отсутствии противопоказаний
Этап послеоперационного контроля
Осуществлено постоянное наблюдение педиатра и кардиолога по месту жительства с осмотрами кардиолога не реже 1 раза в 7 дней в течение первых 1,5-2 мес
Выполнено эхокардиографическое обследование не реже 1 раза в три месяца в течение 1-го года после хирургического вмешательства
Рейтинговая схема для оценки качества рекомендаций
Уровень убедительности рекомендаций
Описание
Процедура или лечение являются полезными/эффективными, они должны быть выполнены/назначены
Процедура или лечение с большой долей вероятности являются полезными/эффективными, их разумно было бы выполнить/назначить
Противоречивые доказательства о пользе/эффективности процедуры или лечения, их выполнение/назначение может быть рассмотрено
Процедура или лечение являются вредными/неэффективными, они не должны выполняться/назначаться
Рейтинговая схема для оценки силы доказательств
Уровень достоверности доказательств
Описание
Уровень доказательности А
Мета-анализы, систематические обзоры, рандомизированные контролируемые исследования
Уровень доказательности В
Когортные исследования, исследования «случай-контроль», исследования с историческим контролем, ретроспективные исследования, исследования серии случаев












